Физика подготовка к ЕГЭ
Элементы термодинамики - Молекулярная физика. Термодинамика - Теоретический материал для подготовки к ЕГЭ
Внутренняя энергия тела равна сумме кинетических энергий беспорядочного движения всех молекул относительно центра масс тела и потенциальных энергий взаимодействия всех молекул друг с другом.
Внутренняя энергия идеального газа представляет собой сумму кинетических энергий беспорядочного движения его молекул; так как молекулы идеального газа не взаимодействуют друг с другом, то их потенциальная энергия обращается в нуль.
Для идеального одноатомного газа внутренняя энергия равна
![]()
Количеством теплоты Q называют количественную меру изменения внутренней энергии при теплообмене.
Удельная теплоемкость — это количество теплоты, которое получает или отдает 1 кг вещества при изменении его температуры на 1 К.
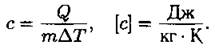
Работа в термодинамике:
работа при изобарном расширении газа равна произведению давления газа на изменение его объема:
![]()
Закон сохранения энергии в тепловых процессах (первый закон термодинамики):
изменение внутренней энергии системы при переходе ее из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе:
![]()
Применение первого закона термодинамики к изопроцессам:
а) изотермический процесс Т = const ⇒ ∆Т = 0.
В этом случае изменение внутренней энергии идеального газа равно
![]()
Следовательно: Q = А.
Всё переданное газу тепло расходуется на совершение им работы против внешних сил;
б) изохорный процесс V = const ⇒ ∆V = 0.
В этом случае работа газа
![]()
Следовательно: ∆U = Q.
Всё переданное газу тепло расходуется на увеличение его внутренней энергии;
в) изобарный процесс р = const ⇒ ∆р = 0.
В этом случае:
![]()
Адиабатным называется процесс, происходящий без теплообмена с окружающей средой:
Q = 0.
В этом случае А = —∆U, т.е. изменение внутренней энергии газа происходит за счет совершения работы газа над внешними телами.
При расширении газ совершает положительную работу. Работа А, совершаемая внешними телами над газом, отличается от работы газа только знаком:
![]()
Количество теплоты, необходимое для нагревания тела в твердом или жидком состоянии в пределах одного агрегатного состояния, рассчитывается по формуле:
![]()
где с — удельная теплоемкость тела, m — масса тела, t1 — начальная температура, t2 — конечная температура.
Количество теплоты, необходимое для плавления тела при температуре плавления, рассчитывается по формуле:
![]()
где λ — удельная теплота плавления, m — масса тела.
Количество теплоты, необходимое для испарения, рассчитывается по формуле:
Q = rm,
где r — удельная теплота парообразования, m — масса тела.
Для того чтобы превратить часть этой энергии в механическую, чаще всего пользуются тепловыми двигателями. Коэффициентом полезного действия теплового двигателя называют отношение работы А, совершаемой двигателем, к количеству теплоты, полученному от нагревателя:
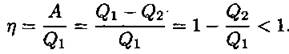
Французский инженер С. Карно придумал идеальную тепловую машину с идеальным газом в качестве рабочего тела. КПД такой машины равен
![]()
В воздухе, представляющем из себя смесь газов, наряду с другими газами находятся водяные пары. Их содержание принято характеризовать термином «влажность». Различают абсолютную и относительную влажность.
Абсолютной влажностью называют плотность водяных паров в воздухе — ρ ([ρ] = г/м3). Можно характеризовать абсолютную влажность парциальным давлением водяных паров — ρ ([ρ] = мм. рт. столба; Па).
Относительная влажность (φ) — отношение плотности водяного пара, имеющегося в воздухе, к плотности того водяного пара, который должен был бы содержаться в воздухе при этой температуре при условии, чтобы пар был насыщенным. Можно измерять относительную влажность как отношение парциального давления водяного пара (р) к тому парциальному давлению (р0), которое имеет насыщенный пар при этой температуре:
![]()