Физика подготовка к ЕГЭ
Газовые законы - Молекулярная физика. Термодинамика - Теоретический материал для подготовки к ЕГЭ
Основные положения молекулярно-кинетической теории (МКТ) заключаются в следующем.
1. Вещества состоят из атомов и молекул.
2. Атомы и молекулы находятся в непрерывном хаотическом движении.
3. Атомы и молекулы взаимодействуют между собой с силами притяжения и отталкивания.
Характер движения и взаимодействия молекул может быть разным, в связи с этим принято различать 3 агрегатных состояния вещества: твёрдое, жидкое и газообразное. Наиболее сильно взаимодействие между молекулами в твердых телах. В них молекулы расположены в так называемых узлах кристаллической решетки, т.е. в положениях, при которых равны силы притяжения и отталкивания между молекулами. Движение молекул в твердых телах сводится к колебательному около этих положений равновесия. В жидкостях ситуация отличается тем, что, поколебавшись около каких-то положений равновесия, молекулы часто их меняют. В газах молекулы далеки друг от друга, поэтому силы взаимодействия между ними очень малы и молекулы движутся поступательно, изредка сталкиваясь между собой и со стенками сосуда, в котором они находятся.
Относительной молекулярной массой Мr называют отношение массы m0 молекулы к 1/12 массы атома углерода mос:
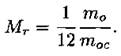
Количество вещества в молекулярной физике принято измерять в молях.
Молем v называется количество вещества, в котором содержится столько же атомов или молекул (структурных единиц), сколько их содержится в 12 г углерода. Это число атомов в 12 г углерода называется числом Авогадро:
![]()
Молярная масса М = Мr ∙ 10-3 кг/моль — это масса одного моля вещества. Количество молей в веществе можно рассчитать по формуле:
![]()
Основное уравнение молекулярно-кинетической теории идеального газа:
![]()
где m0 — масса молекулы; n — концентрация молекул; ![]() — средняя квадратичная скорость движения молекул.
— средняя квадратичная скорость движения молекул.
2.1. Газовые законы
Уравнение состояния идеального газа — уравнение Менделеева-Клапейрона:
![]()
Изотермический процесс (закон Бойля-Мариотта):
Для данной массы газа произведение давления на его объем есть величина постоянная: pV = const при Т = const, m = const, М = const.
В координатах p — V изотерма — гипербола, а в координатах V — Т и р — Т — прямые (см. рис. 4).
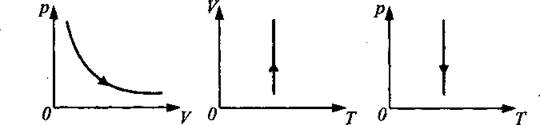
Рис. 4.
Изохорный процесс (закон Шарля):
Для данной массы газа при неизменном объеме отношение давления к температуре в градусах Кельвина есть величина постоянная (см. рис. 5).
![]()
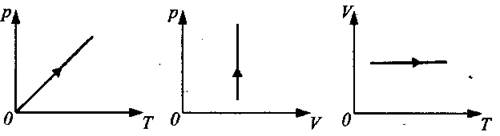
Рис. 5.
Изобарный процесс (закон Гей-Люссака):
Для данной массы газа при неизменном давлении отношение объёма газа к температуре в градусах Кельвина есть величина постоянная (см. рис. 6).
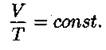
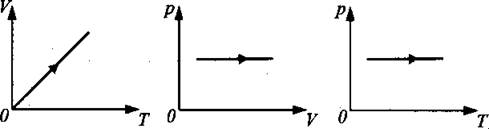
Рис. 6.
Закон Дальтона:
Если в сосуде находится смесь нескольких газов, то давление смеси равно сумме парциальных давлений, т.е. тех давлений, которые каждый газ создавал бы в отсутствии остальных.