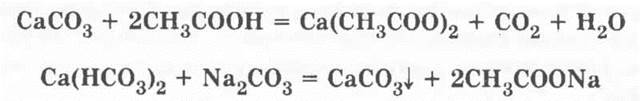Настольная книга учителя по химии 9 класс - поурочные разработки
Оксиды углерода - Неметаллы
Цели урока. Рассмотреть строение, физические свойства, химические свойства, получение и применение угарного и углекислого газов.
Оборудование и реактивы. НСООН и H2SО4 (конц.); известковая вода, «сухой лед», мрамор, НС1, Mg (кусочек или лента). Прибор для получения газов, стаканы, именинные свечи или огарки свечей, подставка — лесенка для них по размерам стакана, лучинка, тигельные щипцы, огнетушитель ОХП или ОХВП, модель огнетушителя, яйцо в молочной бутылке, пробирки, спички.
I. Угарный газ - оксид углерода (II)
Оксид углерода (II) СО позволяет повторить ковалентную полярную связь и закрепить два механизма ее образования: обменный и донорно-акцепторный. Кроме того, рассмотрение строения молекулы этого вещества позволит начать формировать представление о различиях в с. о. элемента и валентности, которая будет рассмотрена в теме «Органические вещества», т. е. выступает в качестве связующего «мостика» между темами курса.
Рассмотрение строения СО начинается с определения с. о. элементов ![]() и соответственно с вывода, сколько электронов передал в общее пользование атом углерода, а значит, и сколько электронов оттянул к себе более электроотрицательный кислород — два.
и соответственно с вывода, сколько электронов передал в общее пользование атом углерода, а значит, и сколько электронов оттянул к себе более электроотрицательный кислород — два.

Однако дальнейшее рассмотрение строения СО показывает, что при таком раскладе сил у углерода не будет заветной восьмерки электронов на внешнем уровне — четыре своих и два общих с атомом кислорода. Как быть? Очевидно, атому кислорода придется передать в общее пользование одну свою свободную электронную пару, т. е. выступить в качестве донора. Акцептором, разумеется, будет атом углерода:
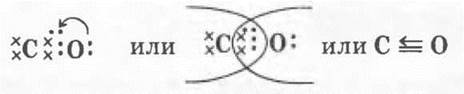
т. е. ковалентных связей будет три, а оттянутых от углерода к кислороду электронов — два (с. о. +2).
Исходя из строения молекулы, учащиеся прогнозируют свойства СО: так как атом углерода потерял еще не все свои электроны, а только два, то СО может проявлять восстановительные свойства, например, с окислителем — кислородом, галогенами или даже с оксидами металлов, восстанавливая их:
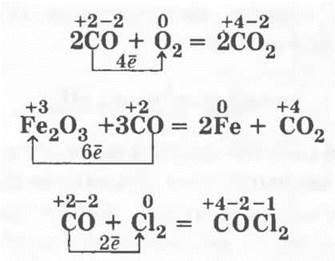
(отравляющее вещество — фосген)
Учитель может использовать возникшую ситуацию, чтобы спрогнозировать и окислительные свойства СО: «Но ведь атом углерода может, очевидно, и забирать у восстановителей потерянные им электроны или даже использовать их сильные восстановительные свойства, и не только взять у них отданные электроны, но и даже большее число их. Кто же может уступить свои электроны, т. е. быть восстановителем?» Ребята нередко называют столь привычный им водород. Учитель соглашается и записывает уравнение реакции получения метанола из синтез-газа:
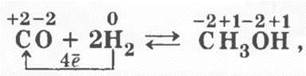 можно записать
можно записать 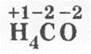
и только после этого учитель рассказывает о физических свойствах оксида углерода (II), о его образовании при горении углеродсодержащих веществ в недостатке кислорода:
![]()
и далее: ![]()
о том, что СО весьма ядовит, так как, попадая в кровь, вызывает отравление организма («угорание», отсюда и название этого оксида).
В количествах, опасных для жизни, он содержится в выхлопных газах автомобилей. Учитель может зачитать какое-нибудь газетное сообщение (они часто появляются в печати) о том, как угорел насмерть заснувший при работающем двигателе в гараже водитель.
Противоядием при отравлении угарным газом служит вдыхание свежего воздуха и чистого кислорода.
Учитель может получить СО нагреванием муравьиной кислоты с H2SО4 (конц.):
![]()
и показать, что СО горит (голубым пламенем), а потому используется как газообразное топливо.
II. Углекислый газ - оксид углерода (IV)
Строение молекулы СО2 ученики разбирают легко:
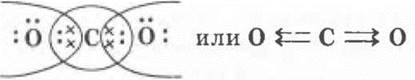
Учителю остается лишь углубить их знания о ковалентной полярной связи и полярности молекулы. Он может поставить проблему: «Почему молекула Н2О — диполь, а молекула СО2 — неполярна?» — и подвести учащихся к выводу о том, что полярность молекулы зависит от двух факторов:
• от полярности связи, которая определяется значениями ЭО элементов, вступающих в связь;
• от геометрии молекулы. Например, Н2О имеет угловое строение и молекула воды полярна, а СО2 имеет линейное строение и, несмотря на полярность химической связи, молекула углекислого газа неполярна.
Затем учитель переходит к рассмотрению получения, собирания и распознавания углекислого газа.
В лаборатории углекислый газ получают действием НСl или HNO3 на мрамор:
![]()
В промышленности оксид углерода (IV) получают обжигом известняка:
![]()
Собирают СO2 способом вытеснения воздуха, так как он тяжелее последнего, но не способом вытеснения воды (почему?).
Распознавание углекислого газа
1. Горящая лучинка, помещенная в сосуд с СO2, гаснет.
2. Известковая вода мутнеет при пропускании через нее СO2.
Свойства углекислого газа начинают рассматривать с физических и биологических свойств: газ, без цвета, запаха, вкуса, тяжелее воздуха, растворим в воде, не поддерживает горения и дыхания.
Здесь можно продемонстрировать «переливание» углекислого газа из стакана в стакан, показать очень наглядный опыт, как по мере накопления СJ2 в большом химическом стакане будут гаснуть поставленные в нем на разную высоту — «лесенкой» небольшие именинные свечи или огарочки (рис. 44).
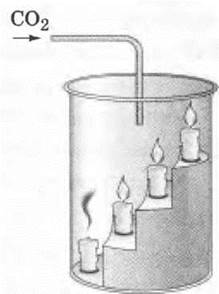
Рис. 44. Демонстрация гашения пламени свечи углекислым газом
Углекислый газ СO2 сжижается уже при комнатной температуре под давлением 6 МПа. В жидком состоянии хранится и транспортируется в стальных баллонах. Если открыть вентиль такого баллона, то жидкий СO2 испаряется, в силу чего происходит его сильное охлаждение и часть газа превращается в снегообразную массу— «сухой лед», который прессуют и используют для хранения мороженого.
Учитель может продемонстрировать эффектный опыт. В стакан с водой опустить несколько небольших кусочков «сухого льда». Вода немедленно забурлит, и из нее повалит густой белый дым, который представляет собой переохлажденные пары воды. Вот вам и «фокус» — «дым» из воды.
Химические свойства СO2 учащиеся рассматривают самостоятельно, как свойства типичного кислотного оксида:
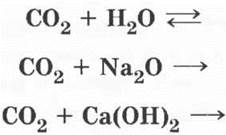
Учителю остается только показать, что, несмотря на то что углекислым газом тушат пожары, им нельзя потушить горящий магний.
Демонстрация проводится просто. С помощью тигельных щипцов в пламени горелки поджигается небольшой кусочек магния или магниевая лента, которые быстро вносятся в стакан, куда предварительно поместили несколько кусочков «сухого льда». Магний продолжает гореть, а в стакане появляются хлопья сажи:
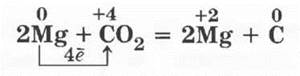
Разбирается ОВР.
Применение углекислого газа рассматривается учащимися самостоятельно с помощью схемы учебника. Учителю остается лишь продемонстрировать огнетушитель ОХП (рис. 45) и объяснить принцип его работы, используя простенькую модель (рис. 46).
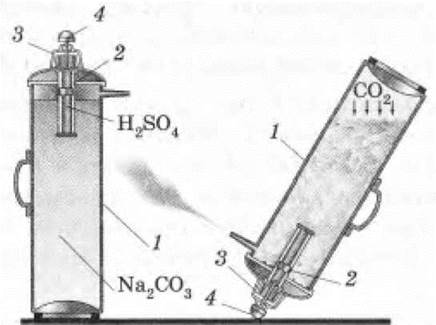
Рис. 45. Огнетушитель:
1 — баллон с раствором соды; 2 — ампула с серной кислотой; 3 — крышка; 4 — штифт
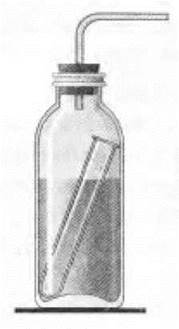
Рис. 46. Модель огнетушителя
В толстостенную и широкогорлую бутылку (например, из-под молока) наливают насыщенный раствор питьевой соды NaHCO3 и немного мыльной воды (для лучшего пенообразования). В раствор опускают небольшую пробирку с концентрированной серной кислотой. Бутылку закрывают пробкой с газоотводной трубкой. Так как в результате взаимодействия соды с кислотой выделяется много углекислого газа, то пробку может выбросить. Во избежание этого ее надо привязать к горлышку бутылки тонкой бечевкой или проволокой.
Для того чтобы показать действие огнетушителя, бутылку наклоняют горизонтально. При этом из пробирки выливается в бутылку серная кислота и вступает в реакцию с содой:
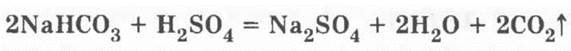
При реакции образуется довольно большой объем углекислого газа, который вместе с брызгами жидкости стремительно выделяется из газоотводной трубки в виде пены. Этой пеной можно погасить небольшой источник огня (например, подожженную бумагу).
III. Занимательный опыт
И в заключение рецептура старого классического опыта о том, как поместить яйцо в бутылку из-под молока.
За сутки перед демонстрацией нужно опустить яйцо в пищевой уксус (9%-ный раствор уксусной кислоты). Затем в молочную бутылку наливается раствор карбоната натрия Na2CO3. Слегка сдавив яйцо, ставшее как бы резиновым, легко пропускают его через горлышко бутылки. Под воздействием карбоната натрия произойдет реакция, восстанавливающая яичную скорлупу. Уравнения процессов: