Настольная книга учителя по химии 9 класс - поурочные разработки
Углерод - Неметаллы
Цели урока. Повторить строение атома и аллотропию на примере углерода. Рассмотреть строение, сравнение свойств и применение алмаза и графита. Дать понятие об аморфном углероде и его сортах. Познакомить учащихся с явлением адсорбции и его практическим значением. Разобрать химические свойства углерода.
Оборудование и реактивы. Модели кристаллических решеток алмаза и графита, иллюстрации с картин В. Боровиковского и фотографии сокровищ Алмазного фонда, образцы изделий из графита (карандаши, электроды и др.) и сажи (тушь, краски, резина и др.), древесный уголь, таблетки карболена, растворы чернил, вишневого компота, сока свеклы; одеколон. Стеклянная трубка диаметром 1,5—2 см (или пробирка с дырявым дном), штатив, вата, речной песок, стакан, колба, прибор для восстановления меди из оксида меди (II), противогаз, кукурузные палочки, пипетка.
I. Строение атома
Учащиеся легко разбирают строение атома и прогнозируют окислительно-восстановительные свойства углерода:
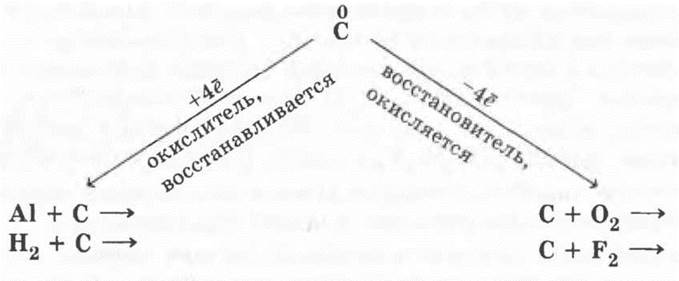
(соответствующие уравнения учащиеся записывают самостоятельно).
II. Аллотропия
Учащиеся вспоминают определение этого явления и называют его причины: для углерода — различное строение кристаллических решеток (учитель демонстрирует модели решеток алмаза и графита):
1) алмаз имеет объемную тетраэдрическую атомную решетку;
2) графит — плоскостную атомную кристаллическую решетку;
3) карбин — линейную.
В качестве экзотической модификации можно показать рисунок фуллерена (рис. 36).
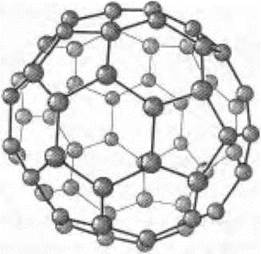
Рис. 36. Фуллерен
Алмаз — прозрачное, бесцветное вещество с сильной лучепреломляемостью. Его плотность 3,5 г/см3. Кристаллы алмаза отличаются особо прочной структурой, благодаря чему он обладает твердостью, превосходящей твердость всех известных в природе веществ. Он в 1000 раз тверже кварца, в 150 раз — корунда. Окраска алмазов обусловливается примесями: встречается даже черный алмаз. Алмазы красивой синей, зеленой и красноватой окраски весьма редки и ценятся очень высоко. Один из самых известных — алмаз «Гоппе» из Индии в 44,5 карата является одним из самых дорогих в мире.
Алмаз — химически очень устойчивое вещество, однако при достаточно высокой температуре (700—800 °С) в атмосфере кислорода он сгорает ослепительным пламенем до СО2.
А что такое «карат»? Учитель дает представление об этой единице измерения драгоценных камней. В аравийской пустыне растет дерево Caratina silikva (каратина силиква), косточка плодов которого (их также называют царьградскими рожками) весит ровно 0,2 г. Этот точный вес косточки имеют всегда: в любой год и на любом дереве. Поэтому ювелиры древности и применяли для своих весов такие гирьки. Кстати, в некоторых странах проба золота выражается также в каратах: она показывает, сколько каратов (т. е. 0,2 г) золота содержится в 24 каратах сплава.
Искусственно ограненные алмазы называются бриллиантами и являются предметом роскоши. В России бриллиантовый бум пришелся на правление Екатерины II. Чтобы судить о сказочности украшений приближенных императрицы, достаточно упомянуть появление Г. А. Потемкина, князя Таврического, фаворита Екатерины II на празднике в Таврическом дворце в парадной шляпе, которую из-за тяжести многочисленных бриллиантов было трудно носить на голове. Не отсюда ли и крылатое выражение о предшественнике императорской короны, о шапке Мономаха: «Тяжела ты, шапка Мономаха».
Шляпе Потемкина не уступал и усыпанный бриллиантами камзол одного из вельмож екатерининских времен, изображенный кистью В. Л. Боровиковского на портрете «Бриллиантового князя» (Русский музей, Санкт-Петербург).
Собрание исторических бриллиантов и изделий из них хранится в Алмазном фонде Оружейной палаты Московского Кремля (рис. 37—41) и золотых кладовых Санкт-Петербургского Эрмитажа.
Алмаз впервые был сожжен в 1694 г. при помощи большого зажигательного стекла. Помещенный в фокус этого стекла, он тлел, как раскаленный докрасна уголь. В 1814 г. английские ученые Дэви и Фарадей также при помощи зажигательного стекла сожгли в кислороде алмаз, который при этом загорался и продолжал гореть спокойным ослепительным пламенем, даже будучи удален из фокуса зажигательного стекла. При этом единственным продуктом сгорания был углекислый газ.
Звезда ордена Св. Андрея Первозванного. Золото, серебро, бриллианты, сапфиры. 8,0X8,0 см. 1805 — 1815 гг. Звезда восьмилучевая, сплошь усыпанная бриллиантами различной величины и украшена тринадцатью мелкими сапфирами.

Рис. 37. Звезда ордена Св. Андрея Первозванного
Алмаз «Шах». Знаменитый исторический алмаз с незначительным желтоватым нацветом, но большой чистоты. На нем три надписи на персидском языке: «Бурхан Низам-шах второй 1000 г.», «Сын Джехангир-шаха Джехан-шах 1051 г.», «Каджар Фатх-Али-шах второй 1242 г.». Камень найден в Центральной Индии в конце XVI в. До 1595 г. хранился у владетелей Ахмеднагары, после чего в результате войн перешел к Великим Моголам, где в 1655 г. известный путешественник Тавернье видел его висящим в качестве талисмана на троне Ауренг-Зеба. В 1739 г. при разгроме Дели шахом Надиром алмаз вместе с другими камнями был увезен в Персию, а в 1829 г. поднесен персидским шахом Хозрев-Мирзой Николаю I как выкуп за убийство русского дипломата и писателя А. С. Грибоедова. Алмаз «Шах» — один из семи исторических камней Алмазного фонда.

Рис. 38. Алмаз «Шах»
Большая императорская корона. Корона состоит из золота, серебра, бриллиантов, шпинели, жемчуга. Высота с крестом 27,5 см, высота самой короны 18,75 см, нижняя окружность 64,0 см, 1762 г. Ювелир И. Позье. Она сделана к коронации императрицы Екатерины II. Корона состоит из двух округлых половин, внизу соединенных обручем и усаженных крупными и мелкими бриллиантами. Верхняя часть половин выполнена в виде густой сквозной решетки, а нижняя — в виде четырех ажурных ветвей, попарно соединенных крупным солитером. Верхние края половин обрамлены рядом крупных жемчужин, заключенных между бриллиантовыми поясками. Обе половины короны разделены от лба до затылка широкой гирляндой из крупных бриллиантов, увенчанной огромной шпинелью. Она является единственным красочным пятном среди моря переливающихся всеми цветами радуги бриллиантов и матового мерцания жемчуга.
Несмотря на свою большую массу (около 2 кг) корона производит впечатление очень легкого изделия. Общее число бриллиантов на короне — 4936 штук, весом 2858 каратов.
Шпинель, венчающая корону, весом 398,72 карата была куплена по указу царя Алексея Михайловича русским посланником Николаем Спафарием у китайского богдыхана Кан Хи в 1676 г. Шпинель является одним из семи исторических камней Алмазного фонда Российской Федерации.
Рис. 39. Большая императорская корона [серебро, бриллианты. Высота с крестом 13,0 см]
Малая императорская корона. Эта корона с превосходными индийскими бриллиантами не имеет себе равных в Европе.
Корона состоит как бы из двух округлых половин, со сквозным сетчатым узором, внизу соединенных обручем и украшенных крупными и мелкими бриллиантами. Обе половины разделены пояском, увенчанным колесом с четырехконечным крестом наверху, также состоящим из бриллиантов. Одно из лучших произведений ювелирного искусства начала XIX в. (1801 г.). Ювелир Л. Дюваль.

Рис. 40. Малая императорская корона
Скипетр императорский сделан из золота, серебра, эмали, бриллиантов, алмаза «Орлов». Длина скипетра с орлом 59,5 см. Начало 70-х гг. XVIII в. Алмаз «Орлов» был подарен императрице Екатерине II графом Орловым в 1774 г.
Камень был найден в Индии в начале XVIII в. и огранен в виде высокой розы. Его первоначальный вес составлял около 300 каратов. По велению шаха Джахана камень был перегранен, после чего он получил форму современного «Орлова» и вес 189,62 карата. Алмаз «Орлов» является одним из семи исторических камней Алмазного фонда РФ. Согласно легенде этот алмаз вместе с другим, ему подобным, был глазом идола в Серингане, откуда он был выкраден французским солдатом в начале XVIII в. Затем алмаз был у шаха Надира, после смерти которого был вторично выкраден и, наконец, куплен графом Г. Г. Орловым у армянского купца Лазарева за 400 тыс. рублей.
Рис. 41. Скипетр императорский
Графит — вещество серо-стального цвета, мягок и жирен на ощупь. Удельный вес его 2,22—2,26 г/см3. Он является хорошим проводником электричества. Кристаллы графита имеют слоистую структуру (расстояние между отдельными атомами одного слоя меньше расстояний между слоями). Этим объясняется особое свойство графита: он оставляет след на бумаге. И эта же способность графита делиться на слои используется для изготовления различных смазок.
К особенностям графита относится его способность гореть в кислороде с образованием СО2 (около 890 °С) при практически совершенной огнестойкости в воздухе. Благодаря исключительной жаропрочности и химической инертности графит используется в реактивных двигателях, для изготовления электродов электрических печей, в ядерных реакторах.
«Аморфный углерод», как было установлено исследованиями, не является еще одним аллотропным видоизменением углерода, а представляет собой мелкокристаллический графит. Сортами этого углерода являются древесный уголь, кокс и сажа.
Сажу получают преимущественно при разложении метана. Она используется для изготовления типографской краски, картриджей, резины, косметической туши и т. д.
Кокс представляет собой в основном свободный углерод, он получается при нагревании каменного угля без доступа воздуха. Кокс применяется в доменных печах при выплавке чугуна из руд.
Древесный уголь получается при нагревании без доступа воздуха древесины. Он применяется в качестве топлива в кузнечных горнах, жаровнях, самоварах, используется в металлургии при выплавке некоторых цветных металлов и особо чистых сортов чугуна, так как не содержит вредных примесей, имеющихся в коксе.
Однако больше известно применение древесного угля, основанное на его способности к адсорбции — способности поглощать (адсорбировать) различные вещества (газы, растворенные в воде краски и т. д.).
Учитель демонстрирует адсорбцию.
1. В стеклянную трубочку (можно использовать пробирку без дна) или стеклянную воронку помещают рыхлый слой ваты, порошок растертого карболена (таблетки активированного угля) и небольшой слой предварительно промытого и высушенного речного песка. Трубку закрепляют в лапке штатива (воронку кладут на кольцо) и наливают в нее разбавленные растворы чернил, перманганата калия, медного купороса, вишневого компота, сока столовой свеклы и т. д. Для собирания жидкости, прошедшей через слой адсорбента, под трубку помещают стакан. В него стекает бесцветная, прозрачная жидкость.
2. В колбу с бурым N02 насыпают измельченный карболен или древесный уголь и несколько раз ее встряхивают. Бурая окраска исчезает.
3. В сухую колбу капают одну каплю одеколона, и колбу нагревают до образования пара. В нее опускают немного измельченного древесного угля, и колбу встряхивают. Запах полностью исчезает.
Адсорбцию можно показать и с помощью обыкновенных кукурузных палочек.
4. Два цилиндра наполняют углекислым газом. В один — помещают несколько кукурузных палочек, и этот цилиндр встряхивают. Затем в два стакана приливают немного известковой воды, а потом в них «переливают» углекислый газ из цилиндров. Раствор известковой воды мутнеет в том стакане, где нет палочек.
Учитель рассказывает, что открытое русским химиком Ловицем явление адсорбции широко используется для очистки сахара на рафинадных заводах от веществ, придающих ему желтый цвет, для очистки спирта, для медицинских целей и т. д. Н. Д. Зелинский на основе адсорбционных свойств древесного угля разработал фильтрующий противогаз (рис. 42).
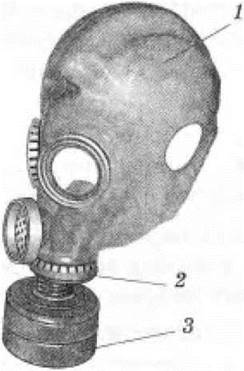
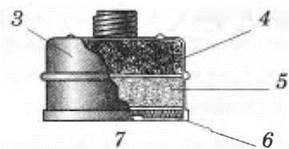
Рис. 42. Устройство фильтрующего противогаза:
1 — шлем-маска;
2 — клапанно-распределительная коробка;
3 — фильтрующая коробка;
4 — активированный уголь;
5 — химический поглотитель;
6 — противодымный фильтр;
7 — вдыхательный клапан
III. Химические свойства углерода
Их учащиеся прогнозируют сами: с металлами, водородом (как окислитель), с более электроотрицательными неметаллами и сложными веществами (как восстановитель) — и записывают уравнения химических реакций.
Учителю остается лишь показать демонстрацию восстановления меди из ее оксида углеродом (рис. 43).
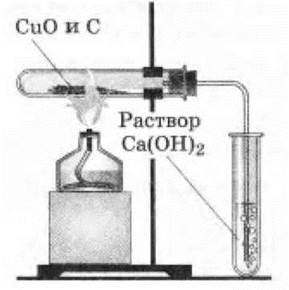
Рис. 43. Восстановление меди из оксида меди (II) углем