Интегрированные уроки Физики 7-11 классы
ТОК В ЭЛЕКТРОЛИТАХ - 10 класс
Тип урока: урок-семинар.
Интеграция предметов: физика — химия.
Пояснительная записка:
1. Из коллектива класса выбирается несколько наиболее способных учащихся.
2. Заданный им заранее материал прорабатывается учащимися самостоятельно.
3. Учителя физики и химии как консультанты проверяют и направляют работу учащихся.
4. На уроке-семинаре основную работу проделывают учащиеся, применяя схемы, таблицы, приборы и т. д.
5. В конце теоретической части семинара проводится практическая ее часть (решение задач интегративного содержания).
6. Семинар рассчитан на учебную пару уроков.
Ход урока
Учитель. Когда электрический ток проходит через металлы, то никакие химические изменения с металлами не происходят. Это объясняется тем, что носителями тока в них являются свободные электроны. Но существуют другого рода проводники, с которыми мы сегодня познакомимся.
Ученик 1. Жидкости, как и твердые тела, могут быть диэлектриками, проводниками и полупроводниками.
Электрический ток — упорядоченное направленное движение заряженных частиц. Значит, ток можно создать только там, где есть свободные заряженные частицы.
Соединим с источником тока последовательно лампочку и ванночку с дистиллированной водой, в которую опущены два угольных электрода.
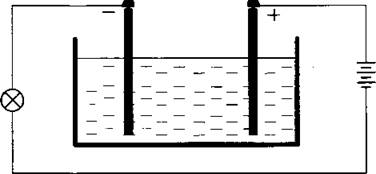
Замкнув цепь, мы увидим, что лампочка не горит, ток в цепи отсутствует. Химически чистая вода является диэлектриком.
Теперь опустим кристалл поваренной соли в дистиллированную воду и, слегка перемешав воду, замкнем цепь. Мы обнаружим, что лампочка, включенная в цепь, светится. Опыт свидетельствует, что раствор поваренной соли в воде является хорошим проводником электрического тока. Следовательно, при растворении соли в воде появляются свободные носители электрических зарядов. Если в дистиллированную воду ввести несколько капель какой-либо кислоты, то так же появится ток в цепи. Растворы солей, кислот и щелочей в воде называют электролитами.
Учитель. Но откуда появились носители заряда? Ведь если сухой кристалл хлорида натрия (NaCl) включить в электрическую цепь, то тока в цепи не будет!
Ученик 2. Молекулы воды полярны. При погружении кристалла хлорида натрия (NaCl) в воду к положительным ионам Na, находящимся в кристалле, молекулы воды притягиваются своими отрицательными полюсами, а к отрицательным ионам Сl молекулы воды поворачиваются положительными полюсами. Это приводит к тому, что взаимодействие ионов Na и Сl в кристалле ослабевает. А тепловое движение приводит к тому, что ионы Na и Сl становятся свободными. Это следует из теории Аррениуса, которую он обосновал еще в 1888 году: молекулы растворившегося вещества будут распадаться на свои составные части.
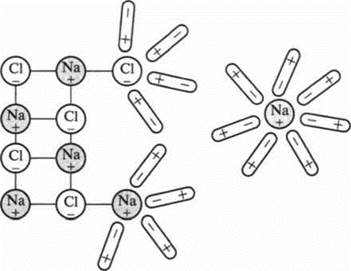
В растворе появляются свободные носители заряда — положительные ионы Na и отрицательные ионы Сl, окруженные полярными молекулами воды.
Процесс, в результате которого под влиянием электрического поля полярных молекул воды происходит распад молекул электролитов на ионы, называют электролитической диссоциацией. «Диссоциация» (латинское слово) означает «разъединение».
![]()
Образовавшиеся ионы, участвуя в хаотическом тепловом движении, могут сблизиться на достаточно малое расстояние и снова объединиться в молекулу. Этот процесс, противоположный диссоциации, называется рекомбинацией.
Когда число молекул, диссоциирующих в единицу времени, становится равным числу молекул, возникающих за то же время вследствие рекомбинации, устанавливается динамическое равновесие.
Долю молекул в растворенном веществе, распавшуюся на ионы, называют степень диссоциации. Степень диссоциации зависит:
1) от температуры раствора;
2) концентрации раствора;
3) диэлектрической проницаемости растворителя.
С увеличением температуры степень диссоциации возрастает и, следовательно, увеличивается концентрация положительно и отрицательно заряженных ионов.
Учитель. Носителями заряда в водных растворах электролитов являются положительные и отрицательные ионы. Но каков же механизм электропроводности растворов электролитов?
Ученик 3. Пока в растворе электролита нет внешнего электрического поля, ионы, образованные в результате диссоциации, движутся хаотически.
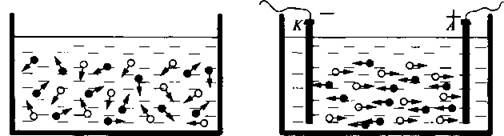
Если сосуд с раствором электролита включить в электрическую цепь, то ионы начинают двигаться направленно. Положительные ионы (катионы) начинают двигаться к катоду (отрицательному электроду), а отрицательные ионы (анионы) движутся к аноду (положительному электроду). В результате устанавливается электрический ток. Так как перенос заряда в растворах электролитов осуществляется ионами, то такая проводимость называется ионной.
Электрический ток в растворах электролитов представляет собой перемещение ионов обоих знаков в противоположных направлениях. Достигнув соответствующего электрода, ионы отдают ему избыточные или получают недостающие электроны и нейтрализуются, то есть теряют таким образом электрический заряд.
Учитель. Мы знаем, что металлические проводники тока обладают сопротивлением. Есть ли оно у электролитов?
Ученик 4. Растворы электролитов обладают электрическим сопротивлением. Это легко проверить. Если собрать цепь и изменить расстояние между катодом и анодом, то обнаружим, что сила тока, протекающая через электролит при постоянном напряжении, изменится.
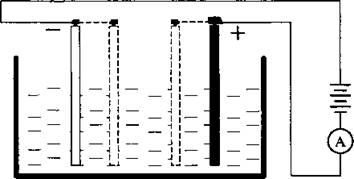
При уменьшении расстояния между электродами сила тока будет увеличиваться. Сила тока будет обратно пропорциональна расстоянию между электродами:
![]()
l — расстояние между электродами.
Если один из электродов приподнять из раствору, то сила тока тоже изменится. Это связано с тем, что меняется площадь поперечного сечения активной части электрода. Сила тока будет прямо пропорциональна площади электрода: I ~ S.
Если изменить концентрацию раствора, то сила тока так же изменится.
Сопротивление электролита можно подсчитать по известной формуле:
![]()
ρ — удельное сопротивление электролита.
Сопротивление электролита будет зависеть от температуры. Сопротивление электролита уменьшается с повышением температуры, так как тепловое движение будет более интенсивным, из-за чего увеличивается число ионов в растворе.
Учитель. При ионной проводимости прохождение тока связано с переносом вещества. Что же можно наблюдать в таком случае?
Ученик 5. На электродах происходит выделение веществ, входящих в состав электролитов. На аноде отрицательно заряженные ионы (анионы) отдают свои лишние электроны. Происходит окислительная реакция. А на катоде положительные ионы (катионы) получают недостающие элементы и восстанавливаются в нейтральные атомы. Происходит восстановительная реакция. Процесс выделения на электроде вещества, связанный с окислительно-восстановительными реакциями, называют электролизом.
Если в водный раствор хлорида меди (СuСl2) опустить два угольных электрода и присоединить их к источнику питания, то через некоторое время мы заметим, что катод покрылся слоем красной меди, а на аноде выделились пузырьки газа, запах которого свидетельствует, что это хлор. Хлорид меди в водном растворе диссоциируется на ионы меди и ионы хлора:
![]()
При подключении источника тока под действием электрического поля положительные ионы меди движутся к катоду, а отрицательные ионы хлора — к аноду. Достигнув катода, ионы Сu++нейтрализуются в атомы меди, получив недостающие два электрона:
![]()
Нейтральные атомы меди оседают на катоде. Ионы хлора, достигнув анода, отдают по одному электрону и превращаются в нейтральные атомы, которые, соединяясь попарно, образуют молекулы хлора:
![]()
Хлор выделяется на аноде в виде пузырьков газа.
Учитель. Ну, а что же может наблюдаться при электролизе других веществ, к примеру растворов кислот?
Ученик 6. Например, молекулы соляной кислоты НСl диссоциируют в растворе также на положительные ионы водорода и отрицательные ионы хлора:
![]()
При прохождении электрического тока через водный раствор соляной кислоты ионы хлора, подойдя к аноду, отдают ему избыточные электроны и превращаются в нейтральные атомы хлора, которые объединяются попарно в молекулы:
![]()
Ионы водорода получают от катода недостающие электроны и нейтрализуются в атомы:
![]()
В результате данного электролиза на катоде выделяется водород, а на аноде — хлор.
Учитель. Как будет протекать электролиз, если угольные электроды заменить металлическими, например медными?
Ученик 7. Конечно, результат будет зависеть от вида электролита. Для примера рассмотрим процесс прохождения тока через раствор сульфата меди CuSO4 в том случае, когда электроды, опущенные в электролит, изготовлены из меди. Диссоциация молекул сульфата меди в воде происходит аналогично:
![]()
Ионы меди, нейтрализовавшись в атомы, откладываются на катоде. Отрицательные ионы SO4--, отдав лишние электроны аноду, тоже нейтрализуются. Нейтральный радикал SO4 вступает в реакцию с медью, поэтому идет реакция с материалом анода:
![]()
Образовавшиеся молекулы сульфата меди переходят в раствор, поэтому при прохождении электрического тока через раствор CuSO4 происходит растворение анода и отложение чистой меди на катоде. Концентрация раствора сульфата меди в этом случае не изменяется.
Учитель. При электролизе на электродах происходит выделение вещества. От чего зависит масса вещества, выделяющегося за определенное время?
Ученик 8. Масса выделившегося вещества определяется массой всех ионов, которые осели на электроде:
![]() moi — масса одного иона; Ni — число ионов.
moi — масса одного иона; Ni — число ионов.
![]() — масса одного иона; М — молярная масса вещества, Na — постоянная Авогадро (число ионов в 1 моле).
— масса одного иона; М — молярная масса вещества, Na — постоянная Авогадро (число ионов в 1 моле).
Тогда ![]()
Число ионов, осевших на электроде, можно выразить через заряд, прошедший через электролит, и заряд одного иона:
![]()
Получим ![]()
Заряд одного иона qoi равен заряду электрона, умноженному на валентность Z:
![]()
Таким образом, масса выделившегося на катоде вещества будет равна:
![]()
В полученной формуле величины NA и е являются универсальными постоянными, a Z и М тоже постоянные для данного вещества, поэтому выражение ![]() — величина постоянная для данного вещества, обозначим ее через К:
— величина постоянная для данного вещества, обозначим ее через К:
![]() тогда m = Kq.
тогда m = Kq.
Из формулы следует, что масса вещества, выделившегося на электроде, пропорциональна заряду, прошедшему через раствор электролита. Эта зависимость была впервые экспериментально установлена английским физиком Фарадеем в 1832 году и носит название закона Фарадея.
Коэффициент K называют электрохимическим эквивалентом веществом. Электрохимический эквивалент численно равен массе вещества, выделившегося на электродах при перенесении ионами заряда в 1 Кл. Но так как ![]() То есть электрохимический эквивалент вещества — это отношение массы иона к его заряду.
То есть электрохимический эквивалент вещества — это отношение массы иона к его заряду.
Электрический заряд, переносимый веществом в количестве 1 моля при электролизе, называют числом Фарадея:
![]()
Объединенный закон Фарадея имеет вид:
![]()
Учитель. Как можно на опыте убедиться в справедливости закона Фарадея?
Ученик 9. Чтобы убедиться в справедливости закона Фарадея, достаточно собрать установку, состоящую из трех электролитических ванн.
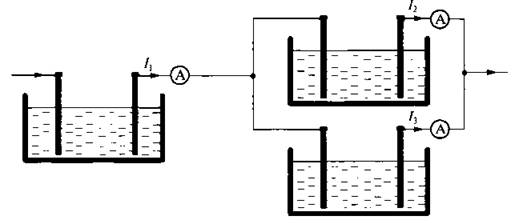
Все три ванны заполнены одним и тем же раствором электролита, но токи, проходящие через них, разные. Ток через первую ванну I1, а через вторую и третью I2 и I3. Измеряя массу веществ, выделяющихся на электродах в разных ваннах, убеждаемся, что они пропорциональны соответствующим силам тока:
m = k · q; так как q = I · t, тогда т = k · I · t. m1 ~ I1; m2 ~ I2; m3 ~ I3.
Учитель. Каково же практическое применение закона Фарадея?
Ученик 10. Закон Фарадея сыграл значительную роль в истории развития науки физики. На основании этого закона впервые определили значение заряда электрона. Это было проделано еще в 1874 году английским физиком Стонем, и независимо от него немецким физиком Гельмгольцем в 1881 году.
Из формулы ![]() следует: q = I · t, тогда
следует: q = I · t, тогда ![]()
Определим заряд электрона:
![]()
Зная, что М — молярная масса выделившегося вещества; I — сила тока в цепи; t — время прохождения тока через электролит; Na — число Авогадро; Z — валентность; m — масса вещества, выделившегося на электроде:
Е = 1,6 · 10-19 Кл.
Учитель. Каково же техническое значение электролиза?
Ученик 11. Явление электролиза нашло широкое применение в современной промышленности. Остановлюсь на одном из них: рафинирование меди. Медь, полученная из руды в плавильных печах, то есть металлургическая медь, содержит разнообразные примеси, то есть не является абсолютно чистой. Для очистки меди от примесей листы металлургической меди опускают в раствор сульфата меди и соединяют с положительным полюсом источника тока. В качестве катода берут тонкие листы чистой меди.
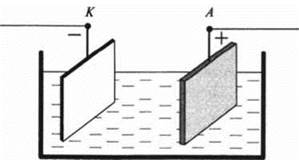
При прохождении тока через электролит на катоде выделяется чистая медь, а анод постепенно растворяется. Примеси при этом выпадают в осадок. Концентрация же сульфата меди в растворе не изменяется.
Электролиз также используется для получения других чистых цветных металлов, в частности, алюминия, магния, кальция.
Ученик 12. Гальваностегия. Некоторые бытовые предметы или детали технических устройств покрывают иногда тонкой пленкой благородного металла: золота, серебра или никеля, хрома. Это делается либо в эстетических целях, либо с целью предохранения от коррозии. В технике отдельные детали чаще покрывают хромом, никелем или кадмием. Такие покрытия осуществляют гальваническим способом.
Деталь, на которую надо нанести покрытие, предварительно очищают от грязи, следов жира и помещают в электролитическую ванну, наполненную раствором соли соответствующего металла.
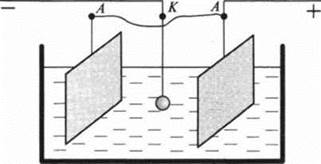
Деталь соединяют с отрицательным полюсом источника тока, то есть деталь служит катодом. Анодом служат пластинки из того же металла, соли которого находятся в электролите. При электролизе на поверхность детали оседает тонкий слой вещества, соли которого находятся в растворе электролита.
Электрический способ покрытия предметов неокисляющимися металлами носит название гальваностегия.
Ученик 13. Гальванопластика. Используя электролиз, можно получить точные рельефные копии, например, с барельефов, статуй, медалей, монет, ювелирных изделий и т. д. Для этого с предмета сначала делают слепок, например, из воска. Затем поверхность этого слепка делают электропроводной, покрывая ее тонким слоем электропроводного вещества, например графита. Подготовленный таким образом слепок помещают в электролитическую ванну в качестве катода. Слепок покрывается толстым слоем металла при пропускании тока через электролит. На матрице, отделенной от слепка, получают негативное изображение рисунка, бывшего на детали, то есть все углубления, бывшие на детали, на матрице будут выпуклыми, и наоборот. Снимая копию с матрицы, можно получить оригинал.
Электролитическое осаждение металла на поверхности предмета для воспроизведения формы называется гальванопластикой. Процесс получения отслаиваемых покрытий — гальванопластика, был разработан русским ученым Якоби, который в 1836 году применил этот способ для изготовления полых фигур для Исаакиевского собора в Петербурге.
В полиграфической промышленности гальванопластика применялась для изготовления гальванопластических копий с цинкографских клише.
Ученик 14. Электролитическая полировка. Количество вещества, которое осаждается на электроде или которое переходит с электрода в раствор, пропорционально силе тока. У выступов, как нам известно, напряженность электрического поля больше, чем на плоских участках. Поэтому если изделие с шероховатой поверхностью поместить в качестве анода в электролитическую ванну с нужным электролитом, то с выступов металл будет переходить в раствор с большей скоростью, и шероховатости будут сглаживаться. На этом принципе основана электрополировка металлов.
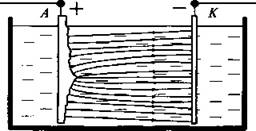
Учитель. Сегодня мы выяснили, что существует такой класс проводников, в которых электрический ток всегда сопровождается их химическими изменениями. Такими проводниками являются растворы солей, кислот и оснований. И эти проводники называют электролитами.
А сейчас, применяя знания, полученные на семинаре, попробуем разрешить несколько интегративных задач.
Задача № 1
В двух электролитических ваннах, которые соединены последовательно, подвергаются электролизу растворы FeCl2 и FeCl3. Одинаковое ли количество железа выделится в ваннах?
Дано:
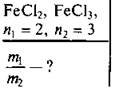
Анализ и решение:
n1 = 2 — валентность железа в соединении FeCl2.
n2 = 3 — валентность железа в соединении FeCl3.
m1 — масса двухвалентного железа, выделившегося на катоде.
m2 — масса трехвалентного железа, выделившегося на катоде.
М — молярная масса железа.
По объединенному закону электролиза:
![]()
Разделив почленно уравнения, получим:
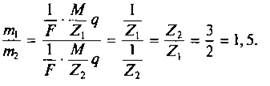
При последовательном соединении ванн токи одинаковы и протекают за одинаковое время одинаковые заряды в этих ваннах, но из раствора FeCl2 выделится железа в 1,5 раза больше, чем из раствора FeCl3.
Ответ. ![]()
Задача № 2
Сколько выделится чистой меди при рафинировании неочищенной меди в течение 8 ч, если напряжение на зажимах всех ванн, соединенных последовательно, равно 120 В, а ЭДС поляризаций 70 В. Внутреннее сопротивление ванн 5 Ом.
Дано:
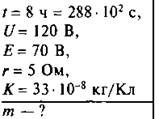
Анализ и решение:
Сила тока на участке цепи с 3 д.с. по закону Ома равна: ![]()
По закону Фарадея, масса меди, выделившейся при электролизе, равна: m = k · q, q = I · t, тогда m = k · I · t, или
![]()
Ответ. m ≈ 0,095 кг = 95 г.
Задача № 3
Аэростат объемом 240 м3 заполнен водородом при температуре 27 °С и давлении 2 · 105 Па. Какое количество электричества нужно пропустить при электролизе через раствор NaCl, чтобы получить необходимое количество водорода?
Дано:
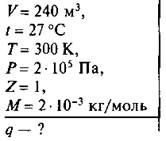
Анализ и решение
![]() — электролитическая диссоциация.
— электролитическая диссоциация.
Водный раствор поваренной соли содержит ионы натрия и хлора. Вода слабо диссоциирует.
![]()
При пропускании тока к катоду помещают ионы водорода. Они присоединяют к себе один электрон, образуя водород.
![]()
К аноду перемещаются ионы хлора; они отдают избыточные электроны, превращаясь в атомы хлора.
![]()
В результате этой реакции происходит электролиз. В растворе увеличивается концентрация ионов натрия Na+ и ОН-, при этом образуется едкий натрий (NaOH).
Найдем массу выделившегося водорода. По уравнению Менделеева-Клапейрона
![]() находим
находим ![]() (1)
(1)
Согласно объединенному закону Фарадея:
![]() (2)
(2)
Приравнивая (1) и (2), получаем:

Ответ. ≈ 1858 · 106 Кл.