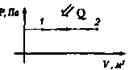Физика - Поурочные планы к учебникам Г. Я. Мякишева, С. В. Громова и В. Л. Касьянова 10 класс
I закон термодинамики - ТЕРМОДИНАМИКА
Цель: сформулировать I закон термодинамики.
Ход урока
I. Повторение изученного
1. Как можно преобразовать хаотическое движение молекул газа в направленное движение макроскопического тела?
2. От каких величин зависит работа, совершаемая силой давления газа?
3. Какую по знаку работу совершает газ при расширении и при сжатии?
4. Какой геометрический смысл имеет работа?
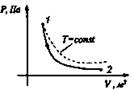
5. Газ, занимающий объем V, и имеющий давление р, расширяется до объема V2 один раз изобарно, другой - изотермически. В каком случае работа расширения газа больше? Докажите ответ графически.
II. Лабораторная работа -«Вычисление изменения внутренней энергии тела при совершении работы»
Приборы и материалы: 1) пробирка химическая, закрытая пробкой; 2) термометр лабораторный от 0 до 100 °С; 3) цилиндр измерительный с носиком 100 мм с холодной водой; 4) лист бумага; 5) таблица «Удельная теплоемкость веществ».
Порядок выполнения работы
1. Налейте в пробирку немного воды (8-10 г) и измерьте ее температуру.
2. Закройте пробирку пробкой и заверните в бумагу. Энергично встряхивайте воду в пробирке в течение 30-40 с.
3. Откройте пробирку и снова измерьте температуру воды.
4. Вычислите изменение внутренней энергии воды.
5. Результаты измерений и вычислений запишите в тетрадь.
6. Ответьте на вопросы:
- Как изменялась внутренняя энергия воды во время опыта?
- Каким способом вы изменяли внутреннюю энергию воды в опыте?
- Зачем пробирку с водой необходимо было заворачивать в бумагу во время опыта?
- Что можно сказать о зависимости изменения внутренней энергии тела от совершенной работы?
III. Изучение нового материала
Исторический процесс изучения тепловых явлений, приведший к формулировке закона сохранения энергии, был длительным и трудным. Различны были методы исследования тепловых и механических явлений, способы измерения единиц таких величин, как количество теплоты и работа.
Прогресс в познании природы теплоты был достигнут, когда было доказано, что при теплообмене сохраняется энергия.
Нагревание тела может происходить без сообщения ему какого-либо количества теплоты, а только за счет совершения работы.
В больших масштабах такое явление наблюдал в 1798 г. Б. Румфорд. При сверлении пушечного ствола, которое производили с помощью лошадей, вращавших большое сверло, Румфорд успевал вскипятить поставленный на ствол котел с водой. Румфорд предположил, что вода нагревается в процессе совершаемой при сверлении работы.
Используя сухие кусочки дерева, можно добыть огонь, т. е. нагреть дерево до температуры, превышающей температуру его воспламенения.
Все перечисленные примеры показали, что количество теплоты сохраняется только при теплообмене, когда не совершается работа. Количество теплоты представляет собой величину, родственную работе. Повышение температуры тела может быть вызвано как совершением работы, так и передачей количества теплоты.
Количество теплоты, как и работу, надо считать мерой изменения энергии системы и выражать ее в тех же единицах, что и работу, т. е. в джоулях.
В середине XIX в. Д. Джоулем были проведены первые опыты, доказывающие эквивалентность количества теплоты, переданного телу, и работы.
В механике закон сохранения был получен из законов Ньютона. Общий закон сохранения энергии, включающий все ее формы, является опытным законом. Он был открыт немецким ученым Р. Майером в середине XIX века, английским ученым Д. Джоулем и получил наиболее полную трактовку в трудах немецкого ученого Г. Гельмгольца.
I закон термодинамики
ΔU = A + Q
Изменение внутренней энергии системы при переходе ее из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданной системе.
Q = ΔU + А
Количество теплоты, переданное системе, идет на изменение ее внутренней энергии и на совершение системой работы над внешними телами.
Применение I закона для изопроцессов (см. таблицу).
|
Название процесса |
График |
Запись закона |
Изменение внутренней энергии |
Физический смысл записи I закона термодинамики |
|
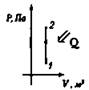
Изохорный V = const |
Нагревание Q > 0, А = 0
|
ΔU = Q |
ΔU > 0 |
Внутренняя энергия газа увеличивается за счет подводимого тепла |
|
Охлаждение Q < 0, А > 0
|
ΔU = -Q |
ΔU < 0 |
Внутренняя энергия газа уменьшается за счет того, что газ отдает тепло окружающей среде |
|
|
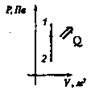
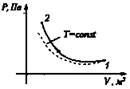
Изотермический T = const |
Расширение Аr > 0, Q > 0
|
Q = Ar |
ΔU = 0 |
Все переданное газу тепло идет на совершение им же работы. |
|
Сжатие Аr < 0, Q < 0
|
Aин.с = -Q |
ΔU = 0 |
При совершении работы внешними силами газ отдает тепло окружающей среде |
|
|
Изобарный P = const |
Нагревание (расширение) Аr > 0, Q > 0
|
Q = ΔU + Ar |
ΔU > 0 |
Подводимое к газу тепло идет на увеличение его внутренней энергии и на совершение газом работы |
|
Охлаждение (сжатие) Аr < 0, Q < 0
|
ΔU = - Ar - Q |
ΔU < 0 |
Внутренняя энергия уменьшается за счет того, что над газом совершается работа и газ отдает тепло окружающей среде |
|
|
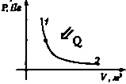
Адиабатный Q = 0 |
Рacширение Аr > 0
|
ΔU = - Ar |
ΔU < 0 |
Внутренняя энергия газа уменьшается за счет того, что сам газ совершает работу. Газ охлаждается. |
|
Сжатие Аr < 0
|
ΔU = Aин.с |
ΔU > 0 |
|
IV. Повторение изученного
1. Как формулируют закон сохранения энергии?
2. В чем состоит эквивалентность количества теплоты, механической работы, затраченной энергии?
3. Что называют первым законом термодинамики? Как записывают и формулируют этот закон?
4. Как записывается первый закон термодинамики для изотермического, изохорного, изобарного и адиабатного процессов?
5. Какой процесс называют адиабатным? При каких условиях он осуществляется?
V. Решение задач
1. При изотермическом расширении идеальным газом совершена работа 15 кДж. Какое количество теплоты сообщено газу?
Дано:
А = 15 кДж = 1,5 · 104 Дж
Т = const
Найти: Q - ?
Решение:
При изотермическом процессе (Т = const) внутренняя энергия газа не меняется, то есть ΔU = 0. Тогда газ совершает механическую работу за счет сообщенного ему количества теплоты:Q = А.
Таким образом, газу сообщено количество теплоты, равное Q = 1,5 · 104 Дж = 15 кДж. (Ответ: Q = 15 кДж.)
2. В закрытом баллоне находится газ. При охлаждении его внутренняя энергия уменьшилась на 500 кДж. Какое количество теплоты отдал газ? Совершил ли он работу?
Дано: ΔU = -500 Дж;
Найти: Q - ? А - ?
Решение:
Газ находится в закрытом баллоне, следовательно, объем газа не меняется, то есть V = const и ΔU = 0.
Газ работу не совершает, т. к. А = Р ΔU → А = 0.
Тогда при изменении внутренней энергии газ отдает количество теплоты, равное Q = -500 Дж (знак «-» показывает, что газ выделяет количество теплоты). (Ответ: Q = -500 Дж; А = 0.)
3. Вычислите увеличение внутренней энергии кислорода массой 0,5 кг при изохорном повышении его температуры на 15 °С.
Дано:
m = 0,5 к.
V = cons.
Δt = 15 °.
ΔТ = 15 °.
Сp = 920 Дж/кг·°К
Найти: ΔU - ?
Решение:
Согласно первому закону термодинамики: ΔU = Q + А.
Работа газа А = РΔU = 0, т. к. V = const, ΔU = 0.
То есть ΔU = Q - внутренняя энергия газа увеличилась за счет получения количества теплоты.
Количество теплоты, полученное кислородом: Q = Cpm · ΔТ, где Ср - удельная теплоемкость кислорода при постоянном давлении (находят из таблиц).
Следовательно, ![]()
(Ответ: ΔU = 6900 Дж = 6,9 кДж.)
4. В цилиндре под поршнем находится 1,25 кг воздуха. Для его нагревания на 4 °С при постоянном давлении было затрачено 5 кДж теплоты. Определите изменение внутренней энергии воздуха, молярная масса которого 0,029 кг/моль.
(Ответ: ΔU = 3567 Дж = 3,567 кДж.)
5. В теплоизолированном цилиндре с поршнем находится азот массой 0,3 кг при температуре 20 °С. Азот, расширяясь, совершает работу 6705 Дж. Определите изменение внутренней энергии азота и его температуру после расширения (Cv = 745 Дж/кг·°К)

Решение:
Расширение азота происходит в теплоизолированном цилиндре, поэтому Q = 0 - нет теплообмена с окружающей средой и первый закон термодинамики примет вид:
ΔU = А = -А’, где А - работа внешних сил, А’ - работа системы.
Следовательно, внутренняя энергия газа при расширении уменьшается на 6705 Дж, т. е. ΔU = -670 Дж. Так как мерой изменения внутренней энергии является количество теплоты, то
![]() откуда
откуда
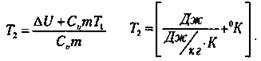
(Ответ: ΔU = -6705 Дж; Т2 = 263 °К; (t = -10° С).)
7. Для изобарного нагревания газа, количество вещества которого 400 моль, на 300 °К ему сообщили количество теплоты 5,4 МДж. Определите работу газа и приращение его внутренней энергии.
(Ответ: А’ = 9,972 · 106 Дж; ΔU = 4,4 МДж.)
Домашнее задание
П. 80, 81. Задачи с. 223 (9-10).
Дополнительный материал
Джеймс Прескотт Джоуль (1818-1889)
Родился Джоуль в Манчестере 24 декабря 1818 г., по профессии был пивоваром. Первые работы Джоуля в физике связаны с изобретением электромагнитных аппаратов, которые были ярким примером превращаемости физических сил. Джоуль был прекрасным экспериментатором. Исследуя законы выделения теплоты электрическим током, он понял, что опыты с гальваническими источниками не дают возможности ответить на вопрос, какой вклад в нагрев проводника вносит переносимая теплота химических реакций, а какой - сам ток.
В результате многочисленных опытов Джоуль пришел к выводу, что теплоту можно получать с помощью механических сил.
В 1843 г. Джоуль нашел механический эквивалент теплоты. Эту величину впоследствии он определял различными способами. Опыты Джоуля просты по идее, но в каждом из них можно найти какую-нибудь экспериментальную тонкость. Например, в последнем, о котором шла речь, для предотвращения движения всей массы воды, к боковым стенкам калориметра в радиальном направлении были прикреплены четыре ряда пластинок; в целях теплоизоляции металлическая ось разделена на две части деревянным цилиндром.
Джоуль внес большой вклад в кинетическую теорию газов, открыв вместе с Томсоном эффект изменения температуры газа при его расширении (Эффект Джоуля- Томсона). Из работ Джоуля непосредственно следовало, что теплота не является веществом, что она состоит в движении частиц. Все это, несомненно, способствовало утверждению и признанию закона сохранения и превращения энергии, открытие которого явилось величайшим завоеванием науки XIX в.
Значение этого закона для науки трудно переоценить. На основе законов сохранения, и в частности закона сохранения и превращения энергии, в науке и технике производятся различные расчеты, предсказываются новые эффекты и явления, с материалистических позиций оцениваются открытия. Если, скажем, новая теория или проект новой установки не противоречат закону сохранения и превращения энергии, то это служит убедительным аргументом в их пользу.
История физики имела дело с сотнями разнообразных, порою очень остроумных машин, предложенных разными авторами в качестве вечного двигателя. Сегодня нам ясно, что работать они не могли, ибо их создание противоречило закону сохранения и превращения энергии. Вот почему сегодня мы говорим о большом методологическом эквилистическом значении закона сохранения энергии. Он указывает на метод исследования, он дает нам возможность предсказать новое.