Химия и повседневная жизнь человека - поурочные разработки
«Папа купил автомобиль...» - Сценарии уроков на основе проблемных заданий
Цель урока. Знакомство с химическими процессами, протекающими при эксплуатации автомобиля.
Оборудование. Натуральные образцы (или пустые упаковки) антифризов, тормозных жидкостей, средств для борьбы с коррозией, автошампуней.
Методические рекомендации по проведению урока
Примерный текст введения к уроку
«Где-то за городом очень недорого папа купил автомобиль...» — эти слова из популярной эстрадной песни знакомы многим из вас. Как вы помните, эта песенка о смешных злоключениях владельца очень старого автомобиля. Такие злоключения знакомы многим российским автомобилистам: старый автомобиль требует заботы и внимания и обязательно знания химии, ведь без них невозможно бороться с коррозией, правильно подобрать грунтовку, краску и растворители при покраске кузова. Не стоит говорить о том, что и новый автомобиль — это настоящий химический реактор на колесах, так что и владелец нового автомобиля не может позволить себе роскоши не интересоваться химией, ведь контроль состава выхлопных газов — обязательная процедура при техосмотре, а это уже чистая химия. Мы предлагаем посмотреть на проблемы автомобилистов глазами химика. Возможно, такой взгляд поможет сделать многие проблемы более разрешимыми.
Задания
9.1. Накачивание автомобильных камер — процесс чисто физический. Но и химик может ответить на вопрос: почему желательно в мороз сильнее накачивать камеры, а с наступлением теплой погоды немного их спускать?
9.2. Сейчас на рынке есть выбор антифризов — жидкостей для охлаждения двигателя, которые устойчивы к замерзанию. Но если вы оказались в такой ситуации, что антифриз приобрести негде, а вам необходимо залить систему охлаждения, можно приготовить самодельный солевой анти
фриз, замерзающий при -45 °С, — раствор, содержащий 32% СаСl2, 7% NaCl, 61% воды. Рассчитайте, сколько солей и воды надо взять, чтобы залить систему охлаждения автомобиля «Жигули», у которого объем охлаждающей системы составляет примерно 6 л.
9.3. Представьте себе, что во время длительного автопробега по лесным дорогам вам необходимо залить в радиатор свежую воду. Природная вода в этой местности только родниковая и колодезная, очень жесткая. Как можно смягчить воду для радиатора в походных условиях, не имея под рукой никаких реактивов?
9.4. Многие из вас знают, что в состав жидкостей для предотвращения замерзания воды в радиаторе — антифризов — входят многоатомные спирты, чаще всего — этиленгликоль. Какие из жидкостей, нередко имеющихся в доме, можно залить в радиатор в безвыходной ситуации?
9.5. Низкозамерзающая жидкость тосол изготовлена на основе этиленгликоля. В инструкциях для автомобилистов указано, что перед ее заливкой систему охлаждения необходимо очистить от накипи. Почему это важно?
9.6. Один из самых доступных препаратов для смягчения воды, заливаемой в системы охлаждения автомобилей, — сода. Рекомендуемая доза — 6—7 г кальцинированной соды на 10 л воды. Можно использовать и кристаллическую соду, но в другом количестве. Рассчитайте, сколько надо взять этого реактива, чтобы заменить 6 г кальцинированной соды.
9.7. У вас возникло подозрение, что работники автозаправочной станции, где вы постоянно заправляетесь, добавляют в бензин воду. У вас в хозяйстве есть гашеная и негашеная известь. Можно ли с помощью этих веществ проверить свои подозрения? Потребуются ли для этого еще какие-то препараты?
9.8 (это задание непосредственно связано с предыдущим). Очевидно, что примесь воды к бензину ухудшает все характеристики работы двигателя. Но в морозную погоду такое мошенничество может привести и к более тяжелым последствиям — двигатель вообще не сможет работать. Что может стать причиной остановки двигателя в мороз, если бензин разбавлен водой?
9.9. Одно из многочисленных правил техники безопасности для автолюбителей, которые привыкли сами заниматься техобслуживанием, — ни в коем случае не приближать открытое пламя или искрящие провода к аккумулятору с открытыми пробками, так как это может привести к взрыву. Какие взрывоопасные вещества могут образоваться в аккумуляторной батарее и за счет какого процесса?
9.10. Аккумуляторные батареи заряжают с помощью зарядных устройств — чаще всего германиевых или селеновых выпрямителей электрического тока, подключенных к осветительной сети. При этом очень важно не перепутать клеммы: клемму «плюс» батареи соединить с положительной клеммой выпрямителя, а клемму «минус» — с отрицательной. Полярность батареи, выпрямителя и генератора можно проверить и без приборов: например, опустить два конца проводов в воду, подкисленную серной кислотой. Тогда отрицательный провод можно немедленно обнаружить по внешним проявлениям. Каким? И чем они обусловлены?
9.11. Определить полярность аккумуляторной батареи и выпрямителя можно при помощи обыкновенной картофелины. Правда, кроме нее, вам потребуются два медных контакта, которые надо воткнуть в свежий срез клубня картофеля на расстоянии 2—3 мм друг от друга и замкнуть цепь. Тогда около положительного провода мякоть клубня начнет синеть. За счет каких процессов это происходит и какова роль картофеля?
9.12. В газете «Московский комсомолец» за 10 сентября 1999 г. было рассказано о деятельности подпольного цеха по производству тормозной жидкости и тосола, обнаруженного милицией в Москве. Эксперты установили, что смесь, которую там изготавливали, угрожала безопасности автомобилистов и объяснили это так: «Для производства тормозной жидкости мошенники использовали воду и бутанол, а для тосола — воду и этилен- гликоль. При температуре —17 °С эти растворы попросту замерзают, а при нагревании до 100 °С — выпадают в осадок. В результате тормоза у машин отказывают при первом же нажатии на педаль, и автомобили становятся фактически неуправляемыми».
Согласны ли вы с таким объяснением?
9.13. Заполнение радиатора автомобиля охлаждающей жидкостью на первый взгляд кажется очень простым делом, но и в нем есть немало тонкостей. Например, тосолом нельзя заполнять радиатор доверху, а только на 2—3 см ниже горловины. В радиатор необходимо периодически добавлять дистиллированную воду. Какими свойствами этиленгликоля можно объяснить эти правила и каким простым способом можно контролировать содержание воды в антифризе при добавлении воды в радиатор и при покупке тосола? И если содержание этиленгликоля в тосоле соответствует норме, значит ли это, что тосол отвечает всем требованиям?
Подсказка. Ознакомьтесь по справочной литературе с физическими свойствами этиленгликоля.
9.14. Автомобилисты на практике нередко добавляют к более дешевым низкооктановым бензинам различные вещества, повышающие их устойчивость к детонации. Этим свойством обладают прежде всего ароматические углеводороды, например толуол. В предыдущие годы, когда в быту широко использовался нафталин как средство от моли, в бензобаки добавляли и его. Действительно, эта уловка позволяла заправлять автомобиль более дешевым бензином. Но при этом у автомобилистов появлялись другие проблемы. Чем они могли быть обусловлены?
9.15. В бензине марки АИ-93 содержится около 0,8 г/л тетраэтилсвинца. Сколько свинца попадет в окружающую среду в результате 1000-километрового пробега легкового автомобиля, если средний расход бензина во время пробега составляет 10 л на 100 км?
9.16. Считается, что дизельное топливо имеет определенные преимущества перед бензином с точки зрения экологии, так как не загрязняет атмосферу свинцом. Но у него есть свои недостатки — при его сгорании образуется много сажи и сернистого газа. Низкосортное дизельное топливо содержит 0,2% серы (в среднем). Сколько сернистого газа попадет в атмосферу при сгорании 1 т такого топлива?
9.17. Перед восстановлением лакокрасочного покрытия автомобилей места, поврежденные коррозией, надо промыть, обезжирить, протравить (удалить продукты коррозии с поверхности). В вашем распоряжении есть следующие вещества: фосфорная кислота, бензин, кальцинированная сода, стеарат натрия, силикат натрия, пропиловый спирт. Какие из них можно использовать: а) для промывки; б) для обезжиривания; в) для травления? Попытайтесь написать уравнения реакций, которые протекают при этих процессах.
Ответы и решения
9.1. Воздух, как и все газы, расширяется при нагревании и сжимается при охлаждении.
9.2. Поскольку мы не знаем плотности раствора, который получим, то не знаем и его общей массы. Неизвестны и необходимые нам массы солей.
Общую массу раствора можно определить по известной массовой доле воды:
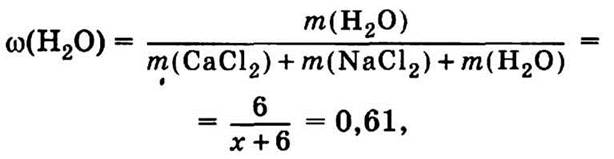
(х + 6) = 6 : 0,61 = 9,84 кг — общая масса раствора.
Тогда хлорида кальция надо взять 9,84 кг · 0,32 = 3,147 кг, а хлорида натрия — 9,84 кг · 0,07 = 0,688 кг.
9.3. Сначала воду надо прокипятить на костре, затем собрать золу от костра и добавить в воду. Профильтровать через ткань или просто осторожно слить верхний слой после отстаивания. Зола содержит значительное количество карбоната калия К2СО3, который осаждает соли кальция и магния.
9.4. В безвыходной ситуации для этой цели можно использовать водку; этиловый спирт; одеколон или лосьон с высоким содержанием спирта; глицерин, разбавленный водой.
9.5. Многоатомные спирты обладают слабыми кислотными свойствами, поэтому способны растворять накипь, которая состоит преимущественно из карбонатов кальция и магния с образованием этиленгликолятов:
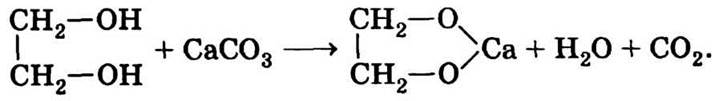
Вследствие этой реакции содержание чистого этиленгликоля в растворе снижается, изменяются ого характеристики. Есть и чисто физическая причина: слой накипи на стенках системы охлаждения препятствует нормальному теплообмену и снижает эффективность охлаждения.
9.6. Кальцинированная сода (Na2CО3), кристаллическая сода (Na2CО3 · 10Н2О).
M(Na2CО3) = 106 г/моль, M(Na2CО3 · 10Н2О) = 286 г/моль.
Необходимо внести 6 г Na2CО3.
В 286 г — 106 г Na2CО3,
в х г — 6 г,
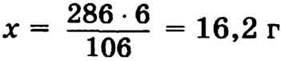 — столько кристаллической соды надо внести для смягчения 10 л воды.
— столько кристаллической соды надо внести для смягчения 10 л воды.
9.7. Если бензин содержит воду, при добавлении негашеной извести образуется Са(ОН)2, раствор приобретает щелочную реакцию, что можно обнаружить с помощью индикатора, например фенолфталеина. Гашеная известь частично растворяется в воде, образуя щелочной раствор. Так что необходим еще и кислотно-щелочной индикатор.
9.8. Вода может замерзнуть в бензопроводе и закупорить его, в результате бензин вообще перестанет поступать в карбюратор.
9.9. Одним из побочных процессов, протекающих в аккумуляторной батарее, является электролиз воды, который в кислотном растворе (электролит H2SО4) протекает по схеме:
на катоде ![]()
на аноде ![]()
Этот процесс может привести к образованию взрывоопасного гремучего газа (смесь двух объемов водорода и одного объема кислорода).
9.10. На проводе, имеющем отрицательный заряд, сразу же начнется выделение пузырьков водорода: ![]()
9.11. На аноде происходит электрохимическое окисление меди (анодное растворение): ![]()
![]()
Образующиеся катионы меди окрашивают мякоть картофеля в синий цвет. Картофельный сок выполняет роль электролита, а белая мякоть картофеля служит хорошим фоном для обнаружения ионов меди.
9.12. Автор заметки, безусловно, не знает ни химии, ни состава антифризов и тормозных жидкостей. Воду и этиленгликоль для производства тосола используют не только мошенники, но и вполне честные производители этого продукта. Мошенничество заключалось, скорее всего, в том, что содержание этиленгликоля в «подпольном» тосоле было значительно ниже нормы, судя по указанной температуре кипения. Антифризы ряда тосола содержат разное количество этиленгликоля и имеют различные температуры замерзания: чем больше этиленгликоля содержится в тосоле, тем ниже температура его замерзания. Тосол марки «А» замерзает при -21,5 °С и содержит 37% этиленгликоля, тосолы А-40 и А-65 замерзают соответственно при -40 и -65 °С. Вторая неточность заключается в описании изменений, происходящих с этими растворами при нагревании. Выражение «при нагревании эти растворы выпадают в осадок» абсолютно некорректно с точки зрения химии. При нагревании могут выпадать в осадок не растворы, а растворенные вещества, но в отношении тосола это неверно.
Разберемся, в чем заключалось мошенничество при изготовлении тормозной жидкости. Одно из основных требований к этим жидкостям — достаточно высокие температуры кипения (не менее 115 °С для барабанных и не менее 190 °С для дисковых тормозов). Не менее важны и низкие температуры застывания (-40 °С для районов с умеренным климатом и -65 °С для северных районов), причем вязкость этих жидкостей должна изменяться очень мало при изменении температуры. Все тормозные жидкости — смеси нескольких веществ, в состав некоторых входит и бутиловый спирт (жидкость БСК — смесь бутилового спирта и касторового масла 1:1). Чтобы тормозная жидкость отвечала всем перечисленным требованиям, соотношение компонентов при ее приготовлении должно соблюдаться очень точно. Нарушение состава приводит к изменению характеристик жидкости, в том числе и к понижению температуры закипания, что действительно опасно.
9.13. Этиленгликоль при нагревании расширяется сильнее воды, поэтому нельзя заливать радиатор доверху. Температура кипения этиленгликоля 197,6 °С, поэтому при нагревании тосола из него удаляются пары воды, и ее необходимо периодически подливать. Контролировать содержание этиленгликоля в тосоле можно по его плотности: плотность тосола А-40 — 1,08 г/см3, тосола А-60 — 1,09 г/см3, чистого этиленгликоля— 1,11 г/см3. Любой антифриз, кроме этиленгликоля, должен содержать антикоррозионные добавки, массовая доля которых обычно составляет около 3%.
9.14. При нагревании и неполном сгорании ароматических углеводородов происходит образование полициклических соединений, нелетучих и термически устойчивых. Эти соединения образуют нагар в головке блока цилиндров, на свечах и на поршне.
9.15. На 1000 км израсходовано 100 л бензина, в воздух попало 100 · 0,8 = 80 г Рb(С2Н5)4.
М(Рb(С2Н5)4) = 323 г/моль.
В 323 г Рb(С2Н5)4 — 207 г Рb,
в 80 г — х.
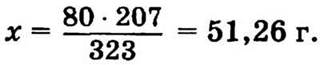
9.16. В 1 т топлива содержится (1000 · 0,2) : 100 = 2 кг серы.
M(SO2) = 64 г/моль.
В 64 кг SO2 — 32 кг S,
в х кг — 2 кг.
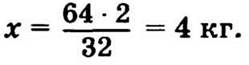
9.17. Для промывки — кальцинированная сода, стеарат натрия, силикат натрия (удаляют также растительные и животные жиры); для обезжиривания — бензин, пропиловый спирт (удаляют все виды жиров, а также минеральные масла); для травления — фосфорная кислота.