Химия ЕГЭ - 1000 заданий с ответами и решениями - 2018 год
Характеристика переходных элементов - меди, цинка, хрома, железа - по их положению в периодической системе химических элементов Д.И. Менделеева и особенностям строения их атомов - Периодический закон и периодическая система химических элементов Д.И. Менделеева - ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИИ
Тесты с выбором ответа с решениями
1. Степень окисления, характерная и для хрома, и для железа, и для меди,
1) +1
2) +2
3) +3
4) +4
2. Верны ли следующие суждения о железе? А. Наиболее характерные степени окисления железа: +2 и +3. Б. Гидроксид железа(II) имеет амфотерные свойства.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
3. Элемент, атомы которого имеют в основном состоянии четыре неспаренных электрона
1) марганец
2) хром
3) ванадий
4) железо
4. Электронная конфигурация внешней оболочки переходного металла
1) 4s2
2) 4s24p1
3) 3d14s2
4) 4s1
5. Электронная формула валентного уровня 3d84s2 имеется у атомов
1) скандия
2) никеля
3) марганца
4) титана
Тесты с выбором ответа для самостоятельного решения
6. Электронная формула валентного уровня 3d14s2 имеется у атомов
1) никеля
2) скандия
3) марганца
4) титана
7. Элемент, атомы которого имеют в основном состоянии пять неспаренных электронов,
1) ванадий
2) железо
3) марганец
4) хром
8. Атом элемента содержит 30 протонов. Гидроксид этого элемента в высшей степени окисления
1) ЭОН
2) Э(ОН)2
3) Э(ОН)3
4) Э(ОН)4
9. Высший оксид элемента, атом которого содержит 23 протона,
1) Э2O3
2) Э2O7
3) ЭO3
4) Э2O5
10. Соединение с формулой К3[Э(ОН)6] характерно для каждого из следующих элементов
1) алюминий и цинк
2) бериллий и цинк
3) хром и алюминий
4) магний и железо
Ответы на тесты раздела
1. 2. 3 1. 2 2. 1 3. 4 4. 3 5. 2 6. 2 7. 3 8. 2 9. 4 10. 3
Решения тестов раздела 1.2.3
Решение 1. Характерные степени окисления хрома в его соединениях +2, +3 и +6. Характерные степени окисления железа в его соединениях +2, и +3. Характерные степени окисления меди в ее соединениях +1 и +2. Степень окисления, характерная для всех трех металлов, +2.
Ответ: 2.
Решение 2. Характерные степени окисления железа в его соединениях +2 и +3. Суждение А верно. Оксиды и гидроксиды двухвалентных металлов имеют, как правило, только основные свойства. Так, гидроксид железа(II) проявляет в обычных условиях только основные свойства и является основным оксидом. Суждение Б неверно.
Ответ: 1.
Решение 3. Напишем электронные формулы металлов с помощью символов, а их валентные уровни — с помощью квантовых ячеек, символизирующих орбитали. Заполнение орбиталей данного подуровня осуществляется в соответствии с правилом Гунда: орбитали заполняются сначала по одному электрону. Из формул, записанных с помощью квантовых ячеек, определяем число неспаренных электронов в основном состоянии каждого атома.
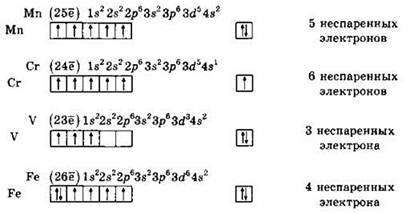
Видно, что четыре неспаренных электрона имеет атом железа.
Ответ: 4.
Решение 4. Переходные металлы — это металлы, в которых происходит заполнение предвнешнего d-подуровня. Валентными электронами для переходных металлов являются s-электроны внешнего уровня и d-электроны предвнешнего уровня. Переходные металлы располагаются в побочных В-подгруппах периодической системы. Поэтому к переходным металлам относится элемент с электронной конфигурацией внешнего уровня 3d14s2. Этот элемент — скандий.
Ответ: 3.
Решение 5. Напишем электронные формулы металлов.
Sc (21ē) 1s22s22p63s23p63d14s2
Ni (28ē) 1s22s22p63s23p63d84s2
Мn (25ē) 1s22s22p63s23p63d54s2
Ti (22ē) 1s22s22p63s23p63d24s2
Конфигурация 3d84s2 имеется у атомов никеля.
Ответ: 2.