Химия ЕГЭ - 1000 заданий с ответами и решениями - 2018 год
Характерные химические свойства оксидов: основных, амфотерных, кислотных - НЕОРГАНИЧЕСКАЯ ХИМИЯ
Тесты с выбором ответа с решениями
1. Из предложенного перечня выберите два соединения, которые реагируют с раствором НСl, но не реагирует с раствором NaOH:
1) FeO
2) СO2
3) N2O
4) MgO
5) CrO3
2. Из предложенного перечня выберите два соединения, которые реагируют с раствором NaOH, но не реагирует с раствором НСl:
1) N2O
2) СО
3) SO2
4) ВаО
5) СO2
3. Из предложенного перечня выберите два соединения, которые реагируют и с раствором NaOH, и с раствором НСl:
1) СuО
2) ВеО
3) NO
4) Аl2O3
5) SO2
4. Из предложенного перечня выберите два соединения, которые не реагируют ни с раствором NaOH, ни с раствором НСl:
1) NO
2) СаО
3) СO2
4) СО
5) Аl2O3
5. Между собой реагируют
1) СаО и SiO2
2) СuО и Na2O
3) N2O5 и CrО3
4) FeO и MgO
6. Из предложенного перечня выберите два оксида, которые растворяются в воде:
1) SiO2
2) СаО
3) Р2O5
4) ВеО
5) Сr2O3
7. При реакции Сl2O с раствором NaOH образуется
1) NaClO2
2) NaClO
3) NaClO3
4) NaCl
8. Что образуется при реакции избытка SO2 с раствором NaOH?
1) Na2SO3
2) Na2SO4
3) NaHSO3
4) NaHSO4
9. Углекислый газ реагирует в водном растворе с каждым из двух веществ
1) Н2O, КСl
2) Na2SO4, Ва(ОН)2
3) Ва(ОН)2, SiO2
4) СаСO3, КОН
10. Что образуется при реакции SO3 с избытком раствора КОН?
1) K2SO3
2) KHSO3
3) K2SO4
4) KHSO4
Тесты с выбором ответа для самостоятельного решения
11. Из предложенного перечня выберите две пары оксидов, в каждой из которых оксиды реагируют между собой:
1) Na2O и FeO
2) Р2O5 и Na2O
3) NO и ВаО
4) Сl2O и SO2
5) СаО и СO2
12. Из предложенного перечня выберите два оксида, которые растворяются в воде:
1) NO2
2) Fe2O3
3) Мn2O7
4) МnO2
5) СО
13. Из предложенного перечня выберите два вещества, образующиеся при взаимодействии раствора КОН с Сl2O7 и с SO3:
1) КСl
2) КСlO4
3) КСlO3
4) K2SO4
5) K2SO3
14. Что образуется при реакции SO2 с избытком раствора NaOH?
1) Na2SO4
2) Na2SO3
3) NaHSO3
4) NaHSO4
15. Из предложенного перечня выберите два вещества, с каждым из которых реагирует оксид серы(IV):
1) HF
2) Н2O
3) O2
4) H2SO4
5) КСl
16. Оксид железа(II) может реагировать с каждым из двух веществ
1) алюминием и соляной кислотой
2) гидроксидом калия и водой
3) серной кислотой и оксидом магния
4) хлоридом натрия и оксидом кальция
17. Оксид цинка может реагировать с каждым из двух веществ
1) хлоридом натрия и соляной кислотой
2) водой и нитратом калия
3) серной кислотой и гидроксидом калия
4) углеродом и оксидом углерода(II)
18. Оксид кальция может реагировать с каждым из двух веществ
1) соляной кислотой и хлоридом натрия
2) водой и оксидом углерода(IV)
3) гидроксидом калия и серной кислотой
4) водородом и оксидом углерода(II)
19. В реакции ![]() оксид серы(IV) проявляет свойства
оксид серы(IV) проявляет свойства
1) восстановительные
2) кислотные
3) основные
4) окислительные
20. Из предложенного перечня выберите два вещества, с каждым из которых реагирует оксид хрома(VI):
1) NaOH
2) НСl
3) O2
4) СO2
5) Н2O
Тесты с кратким ответом с решениями
21. Установите соответствие между названием оксида и формулами веществ, с которыми оксид может взаимодействовать.
|
A) оксид кремния(IV) Б) оксид кальция B) оксид фосфора(V) Г) оксид цинка |
|
22. Установите соответствие между реагирующими веществами и продуктами их взаимодействия.
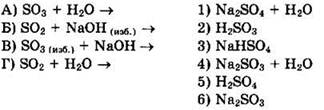
Тесты с кратким ответом для самостоятельного решения
23. Установите соответствие между реагирующими веществами и продуктами их взаимодействия.
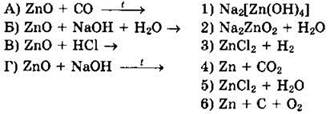
24. Установите соответствие между реагирующими веществами и продуктами их взаимодействия

Ответы на тесты раздела 2.4
1. 14 2. 35 3. 24 4. 14 5. 1 6. 23 7. 2 8. 3 9. 4 10. 3 11. 25 12. 13 13. 24 14. 2 15. 23 16. 1 17. 3 18. 2 19. 4 20. 15 21. 4365 22. 5432 23. 4152 24. 2653
Решения тестов раздела 2.4
Решение 1. Основные оксиды — это, как правило, оксиды металлов в степенях окисления +1, +2: Na2O, CaO, FeO, СrО и др. Оксиды щелочных и щелочноземельных металлов (т.е. металлов IAи IIА групп, кроме Be, Mg) растворимы в воде с образованием щелочей: СаО + Н2O = Са(ОН)2. Другие основные оксиды не растворимы в воде: СuО + Н2O ≠. Основные оксиды реагируют с кислотными оксидами СаО + СO2 = СаСО3 и с растворами кислот СаО + 2НСl = СаСl2 + Н2O. Поэтому реагировать с раствором НСl и не реагировать с раствором NaOH может только основный оксид. В задании указаны: кислотные оксиды СO2 и СrО3, несолеобразующий оксид N2O и основные оксиды FeO и MgO.
Ответ: 14.
Решение 2. Кислотные оксиды — это оксиды металлов в степени окисления +5, +6, +7 и оксиды неметаллов за исключением несолеобразующих оксидов. Кислотные оксиды, кроме Si02, растворимы в воде: SO2 + Н2O = H2SO3. Кислотные оксиды реагируют с основными оксидами SO2 + СаО = CaSO3 и с основаниями SO2 + 2NaOH = Na2SO3 + Н2O. Поэтому реагировать с раствором NaOH и не реагировать с раствором НСl может только кислотный оксид. В задании указаны: несолеобразующие оксиды N2O и СО, кислотные оксиды SO2 и СO2, а также основный оксид ВаО.
Ответ: 35.
Решение 3. Амфотерные оксиды — это оксиды металлов в степенях окисления +3, +4 и иногда +2: ZnO, ВеО, РbО, Аl2O3, Сr2O3, SnO2 и др. Амфотерные оксиды нерастворимы в воде. Амфотерные оксиды взаимодействуют с растворами сильных кислот ZnO + 2НСl = ZnCl2 + Н2О и с растворами щелочей ZnO + 2NaOH + Н2O = Na2[Zn(OH)4]. Поэтому в задании искомыми оксидами являются именно амфотерные оксиды. Такими оксидами в задании являются ВеО и Аl2O3. Кроме того, в задании имеются основной оксид СuО, несолеобразующий оксид NO, кислотный оксид SO2.
Ответ: 24.
Решение 4. Несолеобразующие (безразличные) оксиды — это некоторые оксиды неметаллов: N2O, NO, СО, SiO. Эти оксиды не растворяются в воде и, как правило, не взаимодействуют с растворами кислот и щелочей. Поэтому искомыми оксидами в задании являются именно несолеобразующие оксиды. Такими оксидами в задании являются NO и СО.
Ответ: 14.
Решение 5. Между собой могут реагировать оксиды, которые имеют различающиеся свойства: основные оксиды реагируют с кислотными оксидами. Такой парой оксидов являются СаО и SiO2, где СаО — основный оксид, a SiO2 — кислотный оксид. При нагревании идет образование силиката кальция: СаО + SiO2 = CaSiO3. Оба оксида — СuО и Na3O — основные оксиды. Оба оксида — N2O5 и СrO3 — кислотные оксиды. Оба оксида — FeO и MgO — основные оксиды.
Ответ: 1.
Решение 6. Растворяются в воде: 1) часть основных оксидов — оксиды щелочных и щелочноземельных металлов, 2) все кислотные оксиды, кроме SiO2. То есть растворимы те оксиды, которым соответствуют растворимые гидроксиды. Амфотерные и несолеобразующие оксиды в воде не растворимы. Нерастворимые оксиды имеются в ответе 1 (SiO2), в ответах 4 и 5 (ВеО и Сr2O3 — амфотерные оксиды). Оксид кальция — оксид щелочноземельного металла и оксид фосфора(V) — кислотный оксид. Оба оксида растворимы в воде: СаО + Н2O = Са(ОН)2, Р2O5 + 3Н2O = 2Н3РO4.
Ответ: 23.
Решение 7. При взаимодействии кислотного оксида с водой степень окисления элемента, образующего оксид, как правило, не меняется. В Cl2O степень окисления хлора равна +1. Определим степень окисления хлора в солях, предлагаемых в качестве ответов: +3 в NаСlO2, +1 в NaClO, +5 в NaClO3, -1 в NaCl.
Ответ: 2.
Решение 8. Оксиду серы(IV) соответствует двухосновная сернистая кислота H2SO3, которая образует два ряда солей: средние соли — сульфиты и кислые соли — гидросульфиты. Если на 1 моль кислоты приходится ≤ 1 моль NaOH (недостаток основания, избыток кислотного оксида), то образуется кислая соль: SO2 + NaOH = NaHSO3. Если на 1 моль кислоты приходится ≥ 2 моль NaOH(избыток основания, недостаток кислотного оксида), то образуется средняя соль: SO2 + 2NaOH = Na2SO3 + Н2O. Если на 1 моль кислоты приходится ≥ 1 моль NaOH, но ≤ 2 моль NaOH, то реакция идет с образованием двух солей: NaHSO3 и Na2SO3. В задании указано на избыток SO2, а значит, на недостаток NaOH. В этих условиях образуется NaHSO3. Гидросульфат натрия NaHSO4 образуется при взаимодействии с гидроксидом натрия оксида серы(VI) SO3.
Ответ: 3.
Решение 9. Углекислый газ — кислотный оксид, который реагирует с водой, основаниями и основными оксидами. С кислотным оксидом SiO2 и с такими солями, как КСl и Na2SO4, углекислый газ не реагирует. В водном растворе углекислый газ реагирует с гидроксидом калия СО2 + 2КОН = К2СО3 + Н2O и с некоторыми солями: ![]()
![]()
Ответ: 4.
Решение 10. В избытке гидроксида калия образуется средняя соль, а не кислая соль. Поскольку степень окисления серы в SO3 равна +6, то образующаяся соль будет сульфатом натрия K2SO4, где степень окисления серы также равна +6.
Ответ: 2.
Решение 21. В задании А оксид кремния(IV) — кислотный оксид, который не взаимодействует с водой и с растворами кислот. Поэтому отбрасываем ответы 1, 2, 3, 5, б, в которых имеются кислоты или вода. Остается ответ 4: ![]()
![]()
![]() В задании Б оксид кальция СаО — основный оксид, который не взаимодействует с основаниями. Отбрасываем варианты, в которых имеются основания. Остается ответ 3:
В задании Б оксид кальция СаО — основный оксид, который не взаимодействует с основаниями. Отбрасываем варианты, в которых имеются основания. Остается ответ 3: ![]()
![]() В задании В оксид фосфора(V) — кислотный оксид, который не реагирует с кислотами и магнием. Остается вариант 6:
В задании В оксид фосфора(V) — кислотный оксид, который не реагирует с кислотами и магнием. Остается вариант 6: ![]()
![]()
![]() В задании Г оксид цинка — амфотерный оксид, который реагирует с растворами сильных кислот и щелочей, но не реагирует с водой. Остается вариант 5:
В задании Г оксид цинка — амфотерный оксид, который реагирует с растворами сильных кислот и щелочей, но не реагирует с водой. Остается вариант 5: ![]()
![]()
![]()
Ответ: 4365.
Решение 22. Напишем уравнения требуемых реакций:
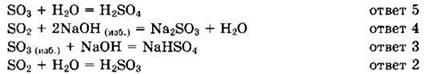
Ответ: 5432.