Химия ЕГЭ - 1000 заданий с ответами и решениями - 2018 год
Классификация химических реакций в неорганической и органической химии - Химическая реакция - ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИИ
Тесты с выбором ответа с решениями
1. Реакция Cu(OH)2+ 2НСl = СuСl2 + 2Н2O является реакцией
1) соединения
2) разложения
3) замещения
4) обмена
2. Из предложенного перечня выберите две реакции, которые не являются окислительно-восстановительными:
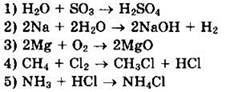
3. Из предложенного перечня выберите две реакции, которые являются реакциями соединения и идут без изменения степеней окисления элементов:

4. Из предложенного перечня выберите две реакции, которые являются экзотермическими реакциями соединения:
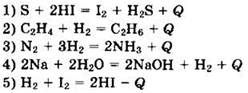
5. К экзотермическим реакциям относится
1) синтез аммиака
2) гидролиз карбоната натрия
3) разложение карбоната кальция
4) взаимодействие азота и кислорода
6. Реакция ![]() является реакцией
является реакцией
1) присоединения
2) отщепления
3) изомеризации
4) замещения
7. Реакция ![]() является реакцией
является реакцией
1) нейтрализации
2) гидролиза
3) этерификации
4) дегидратации
8. Из предложенного перечня выберите две пары веществ, взаимодействие между которыми относится к обратимым реакциям:
1) Н2 и I2
2) С и O2
3) S и O2
4) Н2 и N2
5) Н2 и F2
9. Из предложенного перечня выберите две реакции, которые относится к гомогенным реакциям:
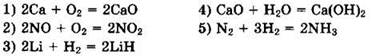
10. Уравнение реакции 2SO2 + О2 = 2SO3 соответствует
1) некаталитической реакции соединения
2) каталитической окислительно-восстановительной реакции
3) каталитической гетерогенной реакции
4) каталитической реакции без изменения степеней окисления
Тесты с выбором ответа для самостоятельного решения
11. Из предложенного перечня выберите две реакции, которые является окислительно-восстановительными реакциями разложения:
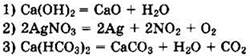
![]()
12. Взаимодействие магния и соляной кислоты является
1) эндотермической реакцией замещения
2) экзотермической реакцией замещения
3) экзотермической реакцией обмена
4) экзотермической реакцией соединения
13. Взаимодействие 2NaOH + H2SO4 = Na2SO4 + 2Н2O является
1) эндотермической реакцией обмена
2) экзотермической реакцией замещения
3) экзотермической реакцией обмена
4) эндотермической реакцией замещения
14. Из предложенного перечня выберите две реакции, которые является эндотермическими реакциями разложения:
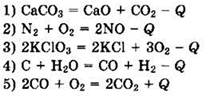
15. Из предложенного перечня выберите две пары веществ, взаимодействие между которыми не является окислительно-восстановительной реакцией:
1) железо и хлор
2) аммиак и хлороводород
3) этан и хлор
4) этанол и муравьиная кислота
5) цинк и соляная кислота
16. Из предложенного перечня выберите два процесса, которые являются экзотермическими процессами:
1) конденсация паров иода
2) кипение воды
3) обжиг известняка
4) плавление льда
5) обжиг пирита
17. Реакция дегидратации — это реакция
1) отщепления воды
2) присоединения водорода
3) присоединения воды
4) отщепления водорода
18. К необратимым реакциям относится взаимодействие между
1) N2 И O2
2) SO2 и O2
3) S и O2
4) Н2 и I2
19. Из предложенного перечня выберите две реакции, которые относятся к гетерогенным реакциям:

20. Уравнение реакции ![]() соответствует
соответствует
1) каталитической гетерогенной реакции
2) каталитической реакции без изменения степеней окисления
3) некаталитической гомогенной реакции
4) каталитической окислительно-восстановительной реакции
Ответы на тесты раздела 1.4.1
1. 4 2. 15 3. 24 4. 23 5. 1 6. 4 7. 3 8. 14 9. 25 10. 2 11. 24 12. 2 13. 3 14. 13 15. 24 16. 15 17. 1 18. 3 19. 14 20. 4
Решения тестов раздела 1.4.1
Решение 1. В зависимости от числа и типа реагирующих и образующихся веществ химические реакции можно разделить на реакции соединения, разложения, замещения и обмена. В ходе реакции соединения из двух веществ образуется одно вещество: S + O2 = SO2. В ходе реакции разложения из одного вещества образуются два вещества: Н2СО3 = Н2O + СO2. В ходе реакции замещения из простого и сложного веществ образуются другие простое и сложное вещества: Fe + CuSO4 = FeSO4 + Сu. В ходе реакции обмена два сложных вещества обмениваются своими составными частями с образованием двух других сложных веществ: NaOH + НСl = NaCl + Н2O. В приведенной в задании реакции два сложных вещества обмениваются своими составными частями с образованием двух сложных веществ, поэтому эта реакция является реакцией обмена. Полезно помнить, что реакцию обмена между основанием и кислотой с образованием соли и воды называют реакцией нейтрализации, а реакцию обмена между кислотой и спиртом с образованием сложного эфира и воды называют реакцией этерификации.
Ответ: 4.
Решение 2. Химические реакции могут протекать как с изменением степеней окисления элементов, так и без изменения степеней окисления элементов. Реакции, протекающие с изменением степеней окисления элементов, называют окислительно-восстановительными. Для того чтобы установить, какая реакция не является окислительно-восстановительной, следует определить, в уравнении какой реакции степени окисления элементов не изменяются. Полезно помнить, что степени окисления простых веществ (в нашем задании это Na, Mg, O2, Сl2) равны нулю. Поскольку в ходе реакций эти вещества превращаются в сложные, то их степени окисления изменяются, что следует проверить, и соответствующие реакции являются окислительно-восстановительными реакциями. Первая и пятая реакции не являются окислительно-восстановительными. Свою степень окисления не меняет ни водород (+1), ни кислород (-2), ни сера (+6), ни азот (-3), ни хлор (-1).
Ответ: 15.
Решение 3. Видно, что первая, вторая и четвертая реакции являются реакциями соединения, а третья и пятая реакции — реакциями разложения. Однако первая реакция является окислительно-восстановительной. Поэтому условиям задания отвечают вторая и четвертая реакции.
Ответ: 24.
Решение 4. В зависимости от термического эффекта химических реакций их можно разделить на экзотермические реакции, протекающие с выделением теплоты, и эндотермические реакции, протекающие с поглощением теплоты. В термохимических уравнениях выделению теплоты соответствует символ +Q (или ΔН < 0), а поглощению теплоты соответствует символ -Q (или ΔН > 0). Таким образом, экзотермическими являются первые четыре реакции, однако реакциями соединения являются только вторая и третья реакции.
Ответ: 23.
Решение 5. Следует помнить, что реакции взаимодействия простых и сложных веществ с кислородом (реакции горения) являются реакциями экзотермическими. Однако реакция азота с кислородом является эндотермической реакцией. Реакции соединения, например синтез аммиака из азота и водорода, — это, как правило, экзотермические реакции. Реакции разложения, например разложение карбоната кальция, — это, как правило, эндотермические реакции. Реакции нейтрализации — экзотермические реакции, а реакции гидролиза солей, в частности гидролиз карбоната натрия, — эндотермические реакции. Таким образом, экзотермической является только первая реакция.
Ответ: 1.
Решение 6. В органической химии имеются следующие типы реакций: замещения ![]() присоединения
присоединения ![]() отщепления, или элиминирования
отщепления, или элиминирования ![]() изомеризации
изомеризации ![]() Среди реакций присоединения различают: гидрирование, галогенирование, гидрогалогенирование, гидратацию, полимеризацию. Среди реакций отщепления (элиминирования) различают: дегидрирование, дегалогенирование, дегидрогалогенирование, дегидратацию. Видно, что приведенная в задании реакция является реакцией замещения.
Среди реакций присоединения различают: гидрирование, галогенирование, гидрогалогенирование, гидратацию, полимеризацию. Среди реакций отщепления (элиминирования) различают: дегидрирование, дегалогенирование, дегидрогалогенирование, дегидратацию. Видно, что приведенная в задании реакция является реакцией замещения.
Ответ: 4.
Решение 7. Реакцию взаимодействия карбоновой кислоты со спиртом, обычно протекающую в кислой среде с образованием сложного эфира и воды, называют реакцией этерификации. Реакцию сложного эфира с водой, обычно протекающую в щелочной среде с образованием спирта и соли карбоновой кислоты, называют реакцией гидролиза, или реакцией омыления. Приведенная в задании реакция является реакцией этерификации.
Ответ: 3.
Решение 8. Необратимые реакции завершаются полным превращением исходных веществ в продукты реакции. Обратимые реакции протекают одновременно в противоположных направлениях и завершаются установлением равновесия между исходными веществами и продуктами реакции. Обратимыми реакциями являются: ![]()
![]() Обратимыми являются реакции этерификации. Реакции гидролиза солей могут быть и обратимыми, и необратимыми. Реакции горения и реакции термического разложения являются, как правило, необратимыми реакциями. Из приведенных в задании реакций обратимыми являются реакции получения иодо- водорода и синтеза аммиака.
Обратимыми являются реакции этерификации. Реакции гидролиза солей могут быть и обратимыми, и необратимыми. Реакции горения и реакции термического разложения являются, как правило, необратимыми реакциями. Из приведенных в задании реакций обратимыми являются реакции получения иодо- водорода и синтеза аммиака.
Ответ: 14.
Решение 9. Гомогенными реакциями называют реакции, в которых исходные вещества образуют одну фазу (газообразную или жидкую). Гомогенные реакции протекают между двумя газами или между двумя смешивающимися жидкостями. Гетерогенными реакциями называют реакции, в которых исходные вещества образуют две разные фазы. Гетерогенные реакции протекают между газом и твердым веществом, между жидкостью и твердым веществом и т.д.
Первая, третья и четвертая реакции — гетерогенные: кальций, литий и оксид кальция — твердые вещества, кислород и водород — газы, а вода — жидкость. Вторая и пятая реакции — гомогенные: оксид азота(II), кислород, азот и водород — газы.
Ответ 25.
Решение 10. Каталитические реакции протекают в присутствии катализатора. Некаталитические реакции протекают в отсутствие катализатора. Каталитическими реакциями являются: реакция синтеза аммиака, реакция получения NO из NH3 и O2, реакция получения SO3 из SO2 и O2 и другие реакции. Указанная в задании реакция идет в присутствии катализатора и является каталитической. Поскольку и SO2, и O2 являются газами, эта реакция гомогенная. Поскольку в ходе реакции меняются степени окисления серы и кислорода, эта реакция окислительно-восстановительная.
Ответ: 2.