Настольная книга учителя по химии 9 класс - поурочные разработки
Подгруппа кислорода - Урок 2 - Ответы - Формирование приемов умственной деятельности у учащихся в курсе химии 9 класса - Приложения
1. а) Символы элементов главной подгруппы VI группы: S, О;
б) состав атомных частиц, соответствующих элементам главной подгруппы VI группы: 8р, 8n, 8ē; 16р, 16n, 16ē;
в) электронные схемы, соответствующие атомам химических элементов главной подгруппы VI группы:
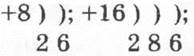
г) изотопы химических элементов главной подгруппы VI группы: ![]()
д) высшие оксиды элементов VI группы главной подгруппы: SO3;
е) летучие водородные соединения элементов главной подгруппы VI группы: H2Se, Н2Те.
2. Ро, Те, Se, S, О.
В указанной уменьшается, электроотрицательность увеличивается, окислительные свойства увеличиваются, неметаллические свойства увеличиваются.
3. а) Вода (элемент — сложное вещество);
б) воздух (чистое вещество — смесь);
в) озон (элемент — аллотропное видоизменение);
г) сжижение (вещество — физическое явление, которое может с ним происходить);
д) горение (вещество — химическое явление, которое может с ним происходить).
5*. 1) S + O2 = SO2 — сера горит в кислороде ярко-голубым пламенем;
2NO + O2 = 2NO2 — оксид азота (II) легко окисляется кислородом и превращается в оксид азота (IV) — бурый газ;
2) 2Na + O2 = Na2O2 — натрий сгорает в кислороде ярко-желтым пламенем;
3) 4Li + O2 = 2Li2O — реакция происходит при обычных условиях; свежесрезанная поверхность лития быстро теряет характерный металлический блеск;
4) 3Fe + 2O2 = Fe3O4 — горение железа в кислороде сопровождается образованием искр;
5) 4Аl + 3O2 = 2Аl2O3 — порошок алюминия или тонкая алюминиевая фольга при сильном нагревании воспламеняются и сгорают ослепительным пламенем;
6) 2Mg + O2 = 2MgO — реакция сопровождается ослепительной вспышкой;
7) 4Р + 5O2 = 2Р2O5 — фосфор горит в кислороде белым, ослепительно ярким пламенем;
8) ![]() — при сильных электрических разрядах азот соединяется с кислородом.
— при сильных электрических разрядах азот соединяется с кислородом.
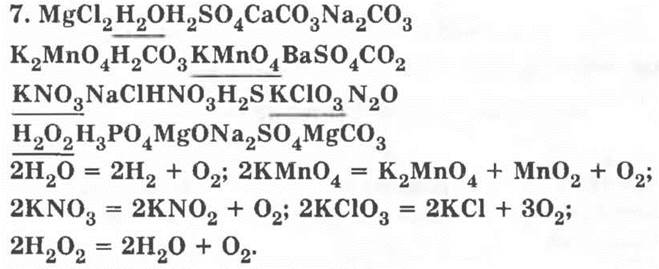
8*. Признаки, по которым можно объединять записанные ве щества в группы: агрегатное состояние, цвет, запах, растворимость в воде, классы неорганических веществ, токсичность, определенные химические свойства, нахождение в природе и т. п.
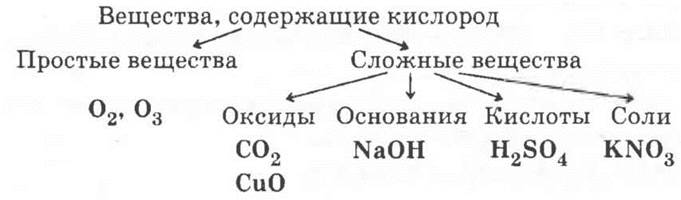
9*. Способ решения 1.

Способ решения 2.
Способ решения 3.
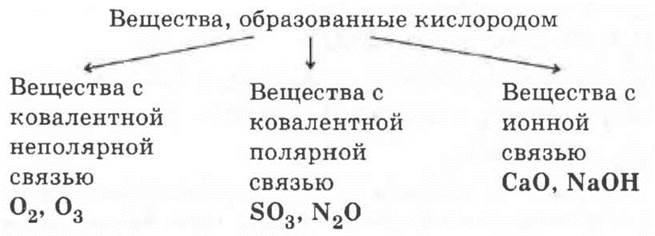
В решении 1 основанием классификации является степень окисления кислорода, в решении 2 — состав веществ, в решении 3 — вид химической связи.
10. Для обозначения: а) химического элемента — 4 раза;
б) простого вещества — 3 раза.
11. О химических явлениях — 4 раза.
О физических явлениях — 2 раза (задания: 3, 4).
13*. См. примеры признаков из задания 8.
14*. а) Токсичное (сероводород, оксид серы (IV)) — нетоксичное (сера, сульфат бария);
б) растворимое в воде (сульфат натрия, серная кислота) — нерастворимое в воде (сера, сульфат кальция);
в) гигроскопичное (серная кислота, оксид серы (VI)) — негигроскопичное (сера, сероводород).
15. а) 6ē (элемент — число электронов на внешнем уровне);
б) 2ē (элемент — число электронов, которых не хватает до завершения внешнего уровня);
в) пластическая сера (элемент — аллотропное видоизменение);
г) гипсовая повязка (вещество — тело);
д) растворение в сероуглероде (вещество — физическое явление, которое может произойти с этим веществом);
е) гниение (вещество — процесс, в результате которого это вещество образуется в природе).
16. Круг 1: NaCl, К2O. Область пересечения: Na2S, CuS.
Круг 2: SO2, H2SO4, H2S.
17*. а) Оксид серы (IV) SO2. Уравнения реакций:
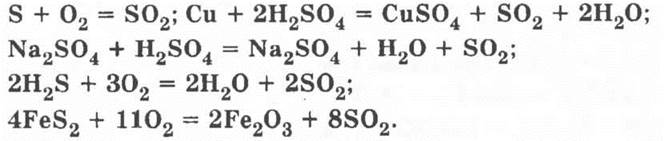
Оксид серы (VI) SO3. Уравнение реакции
![]()
б) сульфат меди (II) CuSO4; уравнения реакций:
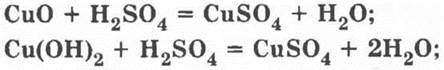
в) сероводород H2S — уравнения реакций:
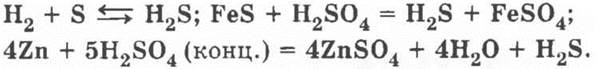
18*. Круг 1: Н2O + SO3 = H2SO4; CaO + SO3 = CaSO4.
Круг 2: H2SO3 ![]() H2O + SO2.
H2O + SO2.
Круг 3: Zn + H2SO4 = ZnSO4 + H2; Cu + 2H2SO4 = CuSO4 + SO2 + 2H2O; 2H2S + O2 = 2S + 2H2O.
Область пересечения 1: Hg + S = HgS; S + O2 = SO2.
Область пересечения 2: SO2 + H2O ![]() H2SO3.
H2SO3.
Область пересечения 3: 2SO3 ![]() 2SO2 + O2.
2SO2 + O2.
Область пересечения 4: H2 + S ![]() H2S; 2SO2 + O2
H2S; 2SO2 + O2 ![]() 2SO3.
2SO3.
19*.
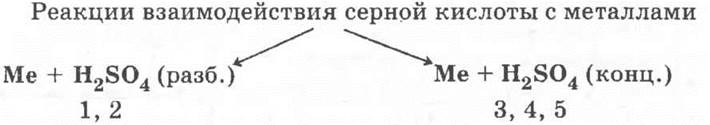
1) Zn + H2SO4 = ZnSO4 + Н2;
2) Сu + H2SO4 → ;
3) 4Zn + 5H2SO4 (конц.) = 4ZnSO4 + 4H2O + H2S;
4) Сu + 2H2SO4 (конц.) = CuSO4 + SO2 + 2H2O;
5) Al + H2SO4 (конц.) → пассивация.
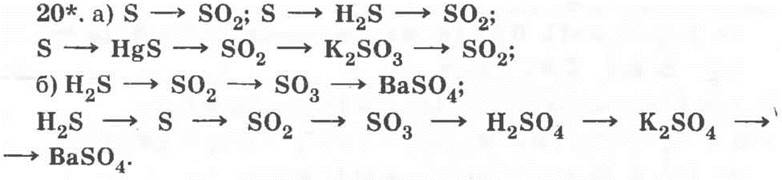
21*. Круг 1. Уравнения реакций:
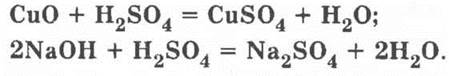
Круг 2. Уравнения реакций:
NaCl + AgNO3 = AgCl + NaNO3.
Область пересечения. Уравнения реакций:
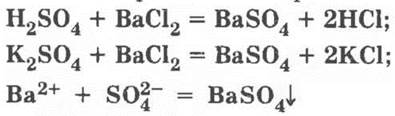 — белый осадок, нерастворимый в кислотах.
— белый осадок, нерастворимый в кислотах.
22. Ответ — аллотропия (таблица 21).
Таблица 21
|
Областииспользования |
Свойства |
||||||
|
Горение серы |
Взаимодействие с металлами |
ВзаимодействиеSO2 с красителями |
Гигроскопичность H2SO4 |
ВзаимодействиеH2SO4 с солями |
H2SO4 - электролит |
Сера — инсектицид |
|
|
Демеркуризация |
Е |
|
Ж |
Д |
Е |
Р |
И |
|
Производство серной кислоты |
|
И |
Б |
К |
Г |
3 |
Е |
|
Осушение газов |
В |
Ж |
М |
|
Н |
М |
С |
|
Отбеливание шерсти, бумаги, шелка |
П |
Г |
|
П |
Ф |
Я |
В |
|
Дезинфекция вещей, воздуха |
|
Б |
Р |
Е |
Г |
Ж |
Н |
|
Заполнение аккумуляторов |
К |
3 |
Д |
С |
У |
|
Я |
|
Получение солянойкисоты |
Е |
М |
Б |
Б |
|
У |
Б |
|
Борьба с с/х вредителями |
|
Г |
Е |
Л |
С |
У |
|
|
Получение фосфорнойкислоты |
В |
К |
Ю |
Д |
|
Ж |
Л |
23*.
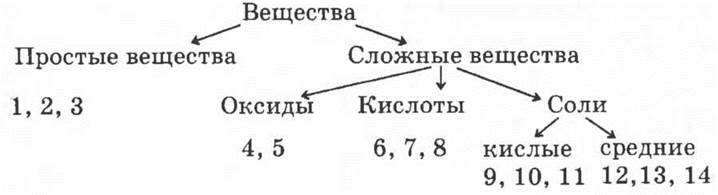
1 — ромбическая сера; 2 — моноклинная сера; 3 — пластическая сера; 4 — SО2; 5 — SО3; 6 — H2S; 7 — H2SО3; 8 — H2SО4; 9 — KHS; 10 — NaHSО3; 11 — KHSО4; 12 — CuS; 13 — Na2SО3; 14 — BaSО4.
24*. Способ решения 1.

Основание классификации — степень окисления серы.
Способ решения 2.
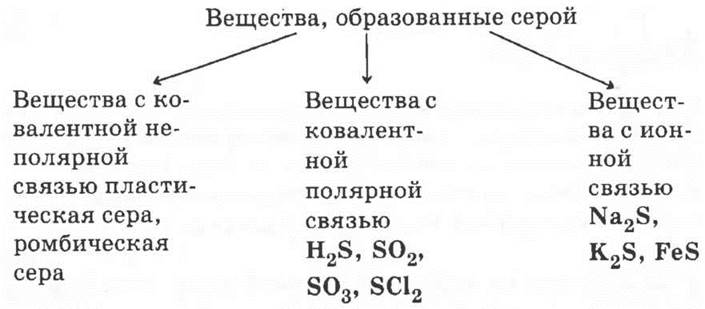
Основание классификации — вид химической связи.
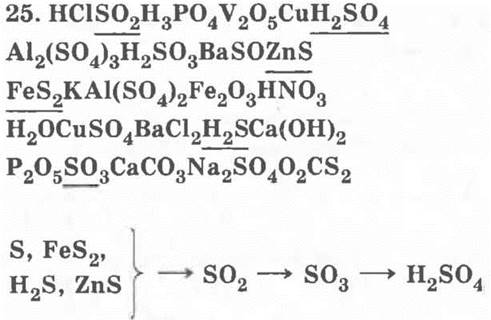
26*. а) Сера, серный колчедан, сероводород, обжиг, горение, оксид серы (IV), «кипящий слой», экзотермическая реакция, огарок, печной газ, механизация процесса, непрерывность процесса, автоматизация процесса и др.;
б) оксид серы (IV), оксид серы (VI), кислород, оксид ванадия (V), обратимая реакция, каталитическая реакция, экзотермическая реакция, циклон, электрофильтр, теплообменник, противоток, понижение температуры, теплообмен и др.;
в) оксид серы (VI), вода, серная кислота, олеум, экзотермическая реакция, необратимая реакция, гетерогенная реакция, невысокая температура, противоток, пар серной кислоты, туман, окружающая среда, поглотительная башня и др.
27. Можно пройти через Н2О, О2, Na2SО4, BaSО4.
28. Для обозначения: а) химического элемента — 8 раз; б) простого вещества — б раз.
29. О химических явлениях — 11 раз.
О физических явлениях — 1 раз (задание 15).