Настольная книга учителя по химии 9 класс - поурочные разработки
Альдегиды - Органические вещества
Цели урока. На основе реакции окисления спиртов на медном катализаторе познакомить учащихся с альдегидами, их представителями, свойствами и применением. Продолжить формирование понятия о гомологической связи между классами органических соединений по цепочке «алкан → алкен → алканол → алканаль».
Оборудование и реактивы. Формалин, растворы глюкозы, аммиака, CuSO4, NaOH, AgNO3, спиртовка. Демонстрационные образцы: ванилин, модели молекул Стюарта—Бриглеба.
I. Альдегиды и их свойства
Вначале рекомендуется кратко повторить материал предыдущего урока. Учитель просит написать реакции окисления метилового и этилового спиртов. Вещества, которые получаются при этом, имеют одну и ту же функциональную группу
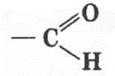
которая называется альдегидной группой.
Органические вещества, в молекулах которых содержится альдегидная группа, связанная с углеводородным радикалом, называются альдегидами.
Начинается гомологический ряд альдегидов веществом, имеющим формулу 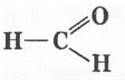 , в котором альдегидная группа связана не с радикалом, а с атомом водорода.
, в котором альдегидная группа связана не с радикалом, а с атомом водорода.
В соответствии с международными правилами названия альдегидов происходят от названия предельных углеводородов с тем же числом углеродных атомов с добавлением суффикса -aль.

метаналь, муравьиный альдегид или формальдегид
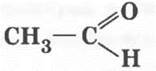
этаналь, уксусный альдегид или ацетальдегид
Однако химики часто пользуются исторически сложившимися названиями самых распространенных веществ, которые отражают либо нахождение вещества в природе, либо характерное его свойство и именуются тривиальными названиями. Метаналю и этаналю повезло — у них даже по два тривиальных названия, учитель записывает их на доске.
Термин альдегиды придумал в 1835 г. немецкий химик Юстус Либих. Он получил несколько альдегидов окислением спиртов и установил, что эти вещества содержат на два атома водорода меньше, чем в исходном спирте. Он назвал их alkohol dehydrogenatus, что значит «безводородные алкоголи», а сокращенно — альдегиды.
Благодаря наличию активной альдегидной группы метаналь и его гомологи являются реакционно-способными соединениями. Наиболее важное их свойство — окисление. Две качественные реакции на альдегидную группу, позволяющие распознать вещества этого ряда, и являются именно реакциями окисления.
Учитель демонстрирует реакции «серебряного зеркала» и окисления альдегида гидроксидом меди (II), описанные в учебнике. В школьной лаборатории нередко отсутствует раствор формалина, поэтому обе реакции можно провести с раствором глюкозы, которая продается в аптеках. Прокомментировать замену формальдегида на глюкозу можно таким образом. Некоторые вещества, которые человек использует в быту или употребляет в пищу, содержат альдегидную группу, то есть являются альдегидами. Правда, эти вещества имеют более сложное строение и содержат несколько функциональных групп, К таким веществам относится глюкоза (или виноградный сахар), которая уже упоминалась на предыдущем уроке, а также всем известный пищевой ароматизатор ванилин. Исследовав с помощью качественной реакции с гидроксидом меди (II) раствор мёда или виноградный сок, можно убедиться, что в этих продуктах содержатся альдегиды.
Продуктами окисления альдегидов являются органические вещества, содержащие новую функциональную группу —СООН, которая называется карбоксильной.
Они относятся к классу карбоновых кислот, о которых пойдет речь на следующем уроке.
Изучением альдегидов занимался выдающийся русский химик и композитор Александр Порфирьевич Бородин, автор знаменитой «Богатырской симфонии» и оперы «Князь Игорь». Его исследования были связаны с другим важнейшим свойством альдегидов — реакциями конденсации, в результате которых происходит соединение молекул альдегидов друг с другом, увеличение молекулярной массы соединений. Если конденсируется множество молекул, реакция называется поликонденсацией, в результате получают полимерные вещества — смолы.
В быту широко применяются феноло-формальдегидные и карбамидные смолы, из которых изготавливают электротехнические изделия (выключатели, розетки), материалы для отделки мебели и интерьеров, древесностружечные плиты, искусственный мрамор, тепло- и звуконепроницаемые пористые материалы, лаки.
Большое количество формальдегида и ацетальдегида используется в промышленности для производства лекарственных веществ и красителей. Широко применяется 40%-ный водный раствор формальдегида — формалин. Его использование основано на способности свертывать белок. Так, например, в кожевенном производстве в результате дубильного действия формалина кожа твердеет и не подвергается гниению. На том же свойстве основано применение формалина для хранения биологических препаратов, формалин используется для дезинфекции и протравливания семян.
Следующую часть урока мы рекомендуем провести только в классах математического или химического профиля.
II. Решение задач на нахождение формулы органического вещества по массовым долям элементов
Решение задач этого типа в органической химии имеет ряд особенностей. Например, если найденная простейшая формула неорганического вещества в подавляющем большинстве случаев совпадает с истинной, то для органических соединений это не всегда так. Поскольку знания неорганической химии еще свежи в памяти учащихся, решение задач данного типа подчеркнет взаимосвязь обоих разделов дисциплины, а также разовьет полученные ранее умения и навыки.
Для большинства задач на нахождение формулы вещества по массовым долям элементов можно придерживаться следующего алгоритма решения.
1. Обозначить формулу вещества с помощью индексов х, у, z и т. д. по числу элементов в молекуле.
2. Если в условии не дана массовая доля одного элемента, вычислить ее «по разности» 100% минус массовые доли всех остальных элементов.
3. Найти отношение индексов х:у:z, которое является отношением частных от деления массовой доли элемента на его относительную атомную массу. Привести частные от деления к отношению целых чисел. Определить простейшую формулу вещества.
4. В задачах на нахождение формул органических веществ часто требуется сравнить относительную молекулярную массу простейшей формулы с Мr истинной, найденной по условию задачи (чаще всего плотности по воздуху или водороду). Отношение этих масс дает число, на которое надо умножить индексы простейшей формулы.
Пример
Углеводород, плотность паров которого по водороду равна 39, содержит 92,31% углерода. Найти его молекулярную формулу.
Дано:
ω(С) = 92,31%
Dн2 (в-ва) = 39
Формула — ?
Решение:
1. Обозначим формулу углеводорода СxНy.
2. Вычислим массовую долю водорода в соединении
![]()
3. Найдем отношение индексов х:у
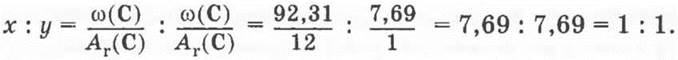
Простейшая формула соединения СН.
4. Рассчитаем относительную молекулярную массу углеводорода:
![]()
Сравним ее с относительной молекулярной массой простейшей формулы:
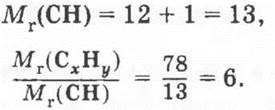
Выяснили, что число атомов обоих элементов в простейшей формуле надо увеличить в 6 раз. Истинная формула вещества С6Н6.
Ответ: С6Н6.
Аналогичные задачи для самостоятельного решения.
1-й уровень
Определите молекулярную формулу углеводорода, содержащего 83,72% углерода и имеющего плотность паров по водороду, равную 43.
2-й уровень
Газообразное органическое соединение имеет такую же плотность по воздуху, как углекислый газ, а массовые доли элементов в нем составляют: С — 81,8%, Н — 18,2%. Какое это соединение?
3-й уровень
Хлорпроизводное предельного углеводорода имеет относительную молекулярную массу 237. Содержание углерода в нем 10,1% , хлора — 89,9% . Определите его формулу.