Настольная книга учителя по химии 9 класс - поурочные разработки
Соли аммония - Неметаллы
Цели урока. Закрепить представления учащихся о составе, получении и распознавании солей аммония. Рассмотреть их физические и химические свойства. Дать краткую характеристику некоторых представителей.
Оборудование и реактивы. Концентрированные растворы НСl, H2SO4, HNO3; кристаллические NH4Cl и Са(ОН)2; лакмусовая бумажка; растворы (NH4)2SO4, AgNO3, ВаСl2, NH4HCO3. Прибор для получения газов, штатив, стеклянная пластинка, пипетка, держатель для пробирок, горелка, спички.
I. Состав и получение солей аммония
Учащиеся легко дают определение солей аммония как сложных веществ, состоящих из катионов аммония и анионов кислотного остатка.
Учитель обращает внимание на уникальность существования ионного типа веществ, образованных только неметаллами. Ведь из всего предыдущего курса у них сложилась четкая логическая линия: металл + неметалл → вещество с ионной связью → ионная кристаллическая решетка.
Так же легко учащиеся называют и способы получения солей аммония — путем взаимодействия с кислотами по донорно-акцепторному механизму. Далее проводится лабораторная работа по получению аммиака и солей аммония.
Прибор для получения аммиака укрепляется в штативе (рис. 30). С помощью пипетки или чистой стеклянной палочки на стеклянную пластину, планшетку или керамическую плитку с углублениями наносится по одной капле концентрированных серной, соляной и азотной кислот. Палочку или пипетку хорошо промывают водой после нанесения каждой кислоты.

Рис. 30. Прибор для наблюдения взаимодействия аммиака с кислотами
В пробирке прибора нагревают смесь NH4Cl и Са(ОН)2, определяют выделение аммиака у отверстия газоотводной трубки прибора по запаху или посинению влажной красной лакмусовой бумажки, а затем перемещают стеклянную пластинку или другую основу так, чтобы капли одна за другой были подведены под отверстие газоотводной трубки. Образуются белые твердые кристаллы солей аммония.
Учитель спрашивает о том, почему над каплями азотной и соляной кислот появляется белый дым, а над каплей серной кислоты — нет. (Учащиеся верно отмечают, что H2SO4 — нелетуча.)
II. Свойства солей аммония
Учитель просит ребят обратиться к таблице растворимости, с помощью которой они убеждаются, что все соли аммония хорошо растворимы в воде.
Учитель подчеркивает, что по физическим свойствам они очень похожи на соли щелочных металлов, прежде всего на соли К+ из-за того, что радиусы ионов К+ и NH4+ близки по размерам. Хлорид аммония NH4Cl похож на NaCl и КСl даже по вкусу, и в этом причина случаев отравления людей, которые использовали КСl или NH4Cl вместо NaCl в пищу. О таких случаях нередко пишут газеты, поэтому можно прочитать какую-либо вырезку из них.
Соли аммония — хорошие электролиты, и их свойства будут определяться ионами, образующимися при диссоциации таких солей.
Первое общее для всех солей аммония свойство определяется наличием в них катиона аммония — взаимодействие солей аммония со щелочами, которое сопровождается выделением аммиака. Последний распознают одним из известных учащимся способом. Эта реакция является качественной реакцией на ион аммония:
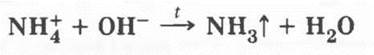
Второе свойство будет особенным для разных классов солей аммония (хлоридов, сульфатов и т. д.). Оно определяется свойствами анионов, образующихся при диссоциации этих солей.
Учащиеся проделывают лабораторную работу по распознаванию растворов хлорида и сульфата аммония
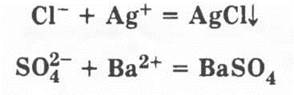
Третье свойство солей аммония — это опять общее свойство; они легко плавятся и разлагаются при нагревании, несмотря на ионный тип кристаллической решетки. Но здесь у каждой соли проявляется особенное и индивидуальное.
Так, соли летучих кислот разлагаются на аммиак и кислоту (особенное), однако понятно, что, например, карбонат аммония даст при этом не кислоту, а углекислый газ и воду.
Учитель демонстрирует химическую возгонку хлорида аммония (нашатыря):
![]()
Аммиак и хлороводород улетучиваются и, соприкасаясь с холодными стенками верхней части пробирки, соединяются вновь (рис. 31):
![]()
Далее учитель демонстрирует полное разложение гидрокарбоната аммония на газообразные — «исчезающие» вещества:
![]()
Его можно купить в магазинах под названием «разрыхлитель теста» или «бакпульвер» (импортный аналог).
Соли летучих кислот, сообщает учитель, например сульфат аммония, разлагаются на аммиак и кислую соль:
![]()
По-особому разлагаются при нагревании соли азотной и азотистой кислот:
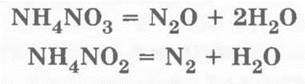
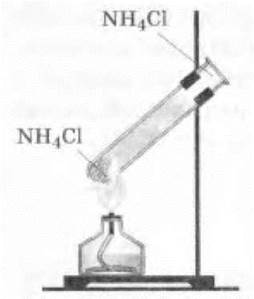
Рис. 31. Возгонка хлористого аммония
III. Применение солей аммония
Учитель обобщает: все соли аммония являются азотными удобрениями. Кроме этого:
• аммиачная селитра NH4NO3 используется в смеси с алюминием для приготовления взрывчатки (аммонала);
• нашатырь NH4Cl применяется при паянии (почему?);
• гидрокарбонат аммония NH4HCO3 — разрыхлитель теста, бакпульвер — при хлебопечении (почему?).